Protocolo del análisis de la viabilidad y la proliferación celulares con MTT
El ensayo con MTT se utiliza para medir la actividad metabólica celular como indicador de la viabilidad, la proliferación y la citotoxicidad celulares. Este ensayo colorimétrico se basa en la reducción de una sal de tetrazolio amarilla (bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio o MTT) a cristales de formazán de color morado por las células metabólicamente activas (Figura 1).6,7,35 Las células viables contienen enzimas oxidorreductasas dependientes del NAD(P)H que reducen el TTM a formazán.36 Los cristales de formazán insolubles se disuelven utilizando una disolución de solubilización y la disolución coloreada resultante se cuantifica midiendo la absorbancia a 500-600 nanómetros con un espectrofotómetro multipocillos. Cuanto más oscura sea la disolución, mayor será el número de células metabólicamente activas viables.
Este sistema de ensayo colorimétrico no radiactivo en el que se utiliza MTT fue descrito por primera vez por Mosmann, T et al.1 y mejorado en los años siguientes por otros investigadores.2-6 El kit de proliferación celular I (MTT) es un kit de ensayo con MTT optimizado que contiene reactivos listos para usar y no requiere pasos de lavado ni la adición de más reactivos. Se trata de un ensayo cuantitativo que permite una manipulación rápida y cómoda de un gran número de muestras. El kit de proliferación celular I (MTT) puede utilizarse para varias aplicaciones, como
- Cuantificación del crecimiento y la viabilidad celulares.1,3,5-7
- Medición de la proliferación celular en respuesta a factores de crecimiento, citocinas y nutrientes.1-3,6,8-12 (véase la fig. 3).
- Medición de la citotoxicidad. Algunos ejemplos son la cuantificación de los efectos del factor de necrosis tumoral a o b 13,14 (véase la figura 2) o la muerte celular inducida por macrófagos15,16 y la evaluación de citotóxicos 17-34 o inhibidores del crecimiento como los anticuerpos inhibidores.
- Estudio de la activación celular.4
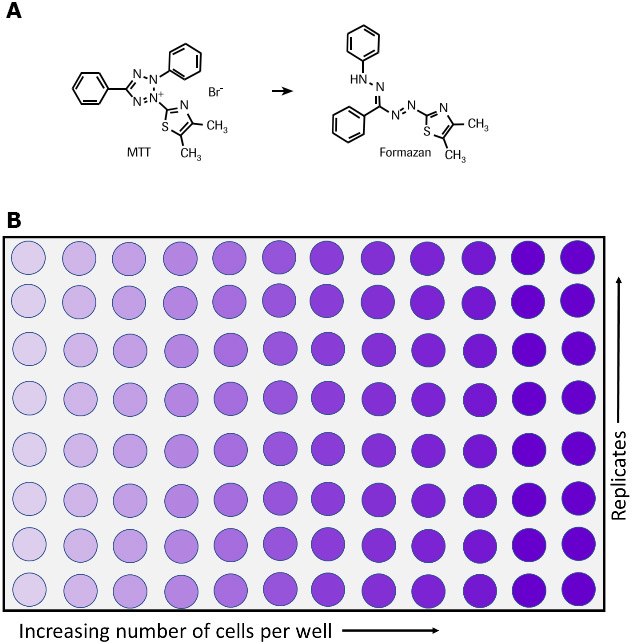
Figura 1.Metabolismo del MTT a una sal de formazán por las células viables como se muestra en la reacción química (A) y en una placa de 96 pocillos (B).
Componentes del kit de proliferación celular (MTT) I (nº de referencia 11465007001)
Reactivo MTT
- Listo para usar, sin esterilizar
- 5 viales que contienen 5 ml de MTT (bromuro de 3-[4,5-dimetiltiazol-2-il]-2,5-difeniltetrazolio) (X1), a 5 mg/ml en disolución salina tamponada con fosfato (PBS, 806552)
Disolución de solubilización
- X1, lista para usar
- 3 frascos de 90 ml
Protocolo del ensayo para medir la citotoxicidad
Otros reactivos requeridos:
- Medio de cultivo, por ejemplo, RPMI 1640 (R0883) que contiene FCS (suero bovino fetal, 12106C) al 10 % inactivado por calor, glutamina 2mM (G6392) y actinomicina C1 1 μg/ml (actinomicina D, A9415).
- Si va a utilizarse un antibiótico, complemente los medios con penicilina/estreptomicina o gentamicina
- Factor de necrosis tumoral-α, humano (hTNF-α) (10 μg/ml), esterilizado (T6674).
Protocolo:
Para la determinación del efecto citotóxico del factor de necrosis tumoral-α (hTNF-α,T6674) en las células WEHI-164 (fibrosarcoma de ratón, 87022501) (véase la Figura 2).
- Preincube las células WEHI-164 a una concentración de 1 x 106 células/ml en medio de cultivo con actinomicina C1 1 μg/ml durante 3 horas a 37 °C y CO2 al 5-6,5 %.
- Siembre las células a una concentración de 5 x 104células/pocillo en 100 μl de un medio de cultivo que contenga actinomicina C1 1 μg/ml y varias cantidades de hTNF-α (concentración final, por ejemplo, 0,001–0,5 ng/ml) en microplacas (calidad cultivo tisular, 96 pocillos, fondo plano).
- Incube los cultivos celulares durante 24 horas a +37 °C y CO2 al 5-6,5 %.
- Después del período de incubación, añada 10 μl del reactivo de marcaje MTT (concentración final 0,5 mg/ml) a cada pocillo.
- Incube la microplaca durante 4 h en una atmósfera humidificada (p. ej., +37 °C, CO2 al 5-6,5 %).
- Añada 100 μl de la disolución de solubilización a cada pocillo.
- Deje la placa reposar toda la noche en la incubadora en una atmósfera humidificada (por ejemplo, +37 °C, CO2 al 5-6,5 %).
- Compruebe la solubilización completa de los cristales de formazán morados y mida la absorbancia de las muestras con un lector de microplacas (ELISA). La longitud de onda para medir la absorbancia del producto formazán es de 550 a 600 nm en función de los filtros disponibles para el lector ELISA utilizado. La longitud de onda de referencia debe ser superior a 650 nm.
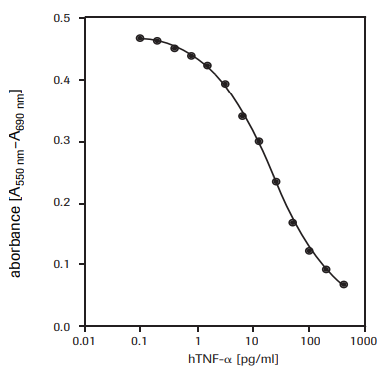
Figura 2.Determinación de la actividad citotóxica del TNF-α humano recombinante (hTNF-α) en células WEHI-164 (fibrosarcoma de ratón) utilizando el ensayo del MTT.
Protocolo de ensayo para medir el crecimiento celular
Otros reactivos requeridos
- Medio de cultivo (por ejemplo, DMEM, nº de referencia D5671) que contiene FCS (suero bovino fetal, referencia 12106C) al 10% inactivado por calor
- Glutamina 2 mM (nº de referencia G6392)
- L-arginina 0,55 mM (nº de referencia A8094)
- Monohidrato de L-asparagina 0,24 mM (nº de referencia A4284)
- 2-Mercaptoetanol 50 μM (nº de referencia M3148),
- Suplemento de medios HT (nº de referencia H0137) (1x), que contiene hipoxantina 0,1 mM y timidina 16 μM. Si va a utilizar un antibiótico, complemente los medios con penicilina/estreptomicina o gentamicina.
- Interleucina-6 humana (hIL-6, nº de referencia SRP3096) (200 000 U/ml, 2 μg/ml) estéril
Protocolo
Para determinar la actividad de la interleucina-6 humana (hIL-6) en células 7TD1 (hibridoma ratón-ratón, DSMZ, ACC 23) (véase fig. 3).
- Siembre las células 7TD1 a una concentración de 2 x 103células/pocillo en 100 μl de medio de cultivo que contenga diversas cantidades de IL-6 [concentración final, por ejemplo, 0.1-10 U/ml (0,001-0,1 ng/ml)] en microplacas (calidad para cultivo tisular, 96 pocillos, fondo plano).
- Incube los cultivos celulares durante 4 días a +37 °C y CO2 al 5-6,5 %.
- Después del período de incubación, añada 10 μl del reactivo de marcaje MTT (concentración final 0,5 mg/ml) a cada pocillo.
- Incube la microplaca durante 4 h en una atmósfera humidificada (p. ej., +37 °C, CO2 al 5-6,5 %).
- Añada 100 μl de la disolución de solubilización a cada pocillo.
- Deje la placa reposar toda la noche en la incubadora en una atmósfera humidificada (por ejemplo, +37 °C, CO2 al 5-6,5 %).
- Compruebe la solubilización completa de los cristales de formazán morados y mida la absorbancia espectrofotométrica de las muestras con un lector de microplacas (ELISA). La longitud de onda para medir la absorbancia del producto formazán es de 550 a 600 nm en función de los filtros disponibles para el lector ELISA utilizado. La longitud de onda de referencia debe ser superior a 650 nm.
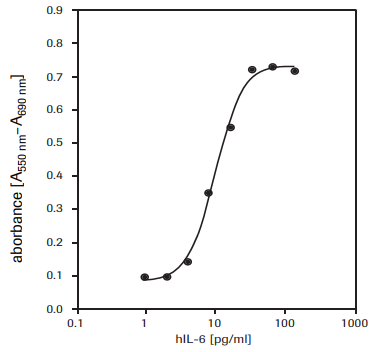
Figura 3.Proliferación de las células 7TD1 (hibridoma ratón-ratón) en respuesta a la interleucina-6 humana recombinante (hIL-6) utilizando el ensayo con MTT.
Ensayos similares
También pueden utilizarse el ensayo con XTT y el ensayo con WST-1 para medir la viabilidad y la proliferación celulares.
Productos
Referencias bibliográficas
References 1-20
References 21-36
Para seguir leyendo, inicie sesión o cree una cuenta.
¿No tiene una cuenta?