Ensayos de viabilidad y proliferación celular
- Ensayos de proliferación de la síntesis de ADN
- Ensayos de proliferación metabólica
- Asayos de viabilidad celular luminiscente
- Asayos de proliferación con tinte fluorescente
- Cultivo celular 3D- Tinción triple de células vivas/muertas/totales
- Cuento de células con azul Tripán
-
Introducción
Los ensayos para medir la proliferación celular, la viabilidad celular y la citotoxicidad se utilizan habitualmente para monitorizar la respuesta y la salud de las células en cultivo tras el tratamiento con diversos estímulos. La elección adecuada de un método de ensayo depende del número y tipo de células utilizadas, así como del resultado esperado. Los ensayos de proliferación celular pueden controlar el número de células a lo largo del tiempo, el número de divisiones celulares, la actividad metabólica o la síntesis de ADN. El recuento de células utilizando colorantes de viabilidad como el azul tripán o la Calceína-AM puede proporcionar tanto la tasa de proliferación como el porcentaje de células viables.
Visión general de los ensayos de viabilidad y proliferación celular
Preparación de los ensayos de viabilidad y proliferación celular
Preparación de los ensayos de viabilidad y proliferación celular
Ensayos de proliferación de ADN
Ensayo de proliferación celular con BrdU
La proliferación celular puede estudiarse monitorizando la incorporación de un radioisótopo, [3H]-timidina, en el ADN celular, seguido de autorradiografía. Alternativamente, puede utilizarse 5-bromo-2′-deoxi-uridina (ensayos de BrdU) en lugar de timidina. Las células que han incorporado BrdU en su ADN se detectan fácilmente utilizando un anticuerpo monoclonal contra BrdU y un anticuerpo secundario conjugado con enzima o fluorocromo.

Figura 1.A, Células proliferantes en el ojo del embrión de pollo E4 mediante tinción con BrdU B, Validación del anticuerpo anti-BrdU mediante camptotecina. Al tratar las células Jurkat con el agente de detención del ciclo celular camptotecina, las células circulantes quedan atrapadas en la transición de fase G1/S.
Ensayos de proliferación con EdU
Los ensayos de proliferación con EdU Baseclick proporcionan un método eficaz para la detección por fluorescencia de ADN en replicación. El nucleósido EdU modificado se añade a células vivas y se incorpora al ADN en replicación. La química de clic inducida por Cu permite la rápida unión de sondas fluorescentes al EdU. Esto proporciona una forma cuantitativa de monitorizar las células que están proliferando. Los ensayos están disponibles en varios formatos para imágenes microscópicas, citometría de flujo, cribado de alto rendimiento y para experimentos in vivo. Se dispone de cuatro sondas fluorescentes diferentes con picos de excitación de 488, 555, 594 y 647 para la capacidad de multiplexación con otras sondas fluorescentes.
Las sondas fluorescentes están disponibles en cuatro formatos diferentes.
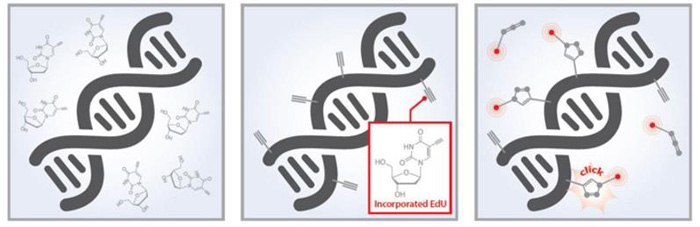
Figura 2.Los kits de proliferación celular Edu-Click incorporan EdU (5-etil-2'-desoxiuridina) en el ADN durante la síntesis activa de ADN y se miden mediante un método de detección fluorescente por química de clic.
Ensayos de proliferación metabólica
Los ensayos que miden la actividad metabólica son adecuados para analizar la proliferación, la viabilidad y la citotoxicidad. La reducción de sales de tetrazolio como MTT, XTT, y WST-1 a compuestos de formazán coloreado o la biorreducción de la resazurina sólo se produce en células metabólicamente activas. Las células que proliferan activamente aumentan su actividad metabólica, mientras que las células expuestas a toxinas tendrán una actividad disminuida.
Ensayos de proliferación celular con MTT
El MTT (bromuro de 3-[4,5-dimetiltiazol-2-il]-2,5-difeniltetrazolio; azul de tiazolilo) es una sal de tetrazolio soluble en agua que produce una solución amarillenta cuando se prepara en medios o soluciones salinas que carecen de rojo de fenol. El MTT disuelto se convierte en un formazán púrpura insoluble por escisión del anillo de tetrazolio por enzimas deshidrogenasas. Este formazán insoluble en agua puede solubilizarse utilizando isopropanol u otros disolventes, y el material disuelto se mide espectrofotométricamente utilizando la absorbancia en función de la concentración de colorante convertido.
Ensayos de proliferación celular con XT
A diferencia del MTT, el producto de escisión de XTT es soluble en agua; por lo tanto, no se requiere un paso de solubilización. La sal de tetrazolio XTT se descompone en formazán mediante un complejo mecanismo celular. Esta biorreducción se produce únicamente en células viables y está relacionada con la producción de NAD(P)H a través de la glucólisis. La cantidad de colorante formazán formado se correlaciona directamente con el número de células metabólicamente activas en el cultivo.
Ensayos de proliferación celular con WST-1
La sal de tetrazolio estable WST-1 se descompone en formazán soluble mediante un complejo mecanismo celular que ocurre principalmente en la superficie celular. Esta biorreducción depende en gran medida de la producción glucolítica de NAD(P)H en células viables. La cantidad de colorante formazán formado se correlaciona directamente con el número de células metabólicamente activas en el cultivo.
Guía de protocolo: ensayo WST-1 para viabilidad y proliferación celular. Protocolos, preguntas frecuentes y solución de problemas
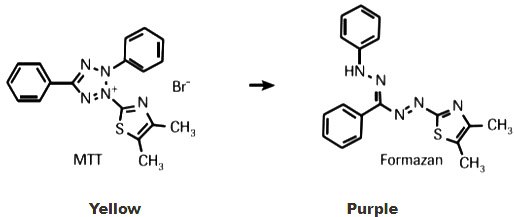
Figura 3.El ensayo MTT es un ensayo colorimétrico para evaluar la proliferación celular basado en la actividad metabólica. Las enzimas oxidorreductasas celulares dependientes de NAD(P)H reflejan el número de células viables presentes. Estas enzimas son capaces de reducir el colorante amarillo de tetrazolio MTT 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio bromuro a su formazán insoluble, que tiene un color púrpura.
Ensayos luminiscentes de viabilidad celular
Dado que el ATP es un indicador de células metabólicamente activas, el número de células viables puede evaluarse en función de la cantidad de ATP disponible. El ATP Cell Viability Luciferase Assay ofrece un ensayo homogéneo altamente sensible para cuantificar el ATP en cultivos celulares. Este kit emplea luciferasa de luciérnaga para oxidar D-Luciferina y la producción resultante de luz para evaluar la cantidad de ATP disponible en cultivos celulares. El procedimiento de ensayo sensible implica una única adición del cóctel de detección de ATP directamente a las células cultivadas en un medio suplementado con suero. No es necesario lavar las células, eliminar el medio ni realizar múltiples pipeteos. El kit es lo suficientemente sensible como para detectar una sola célula o 0,01 picomoles de ATP. La señal producida es lineal dentro de seis órdenes de magnitud. Al relacionar la cantidad de ATP con el número de células viables, el ensayo tiene amplias aplicaciones, que van desde la determinación del número de células viables hasta la proliferación celular y la citotoxicidad celular.
Detección de ATP.
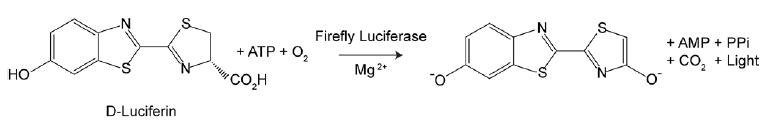
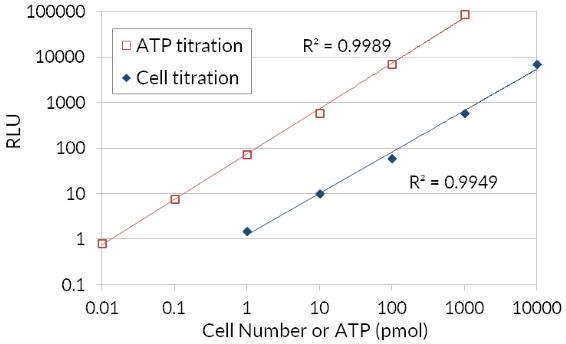
Figura 4.Ensayo de viabilidad celular de la luciferasa ATP bioluminiscente. El uso de luciferasa de luciérnaga de ATP para oxidar D-Luciferina y la producción resultante de la luz con el fin de evaluar la cantidad de ATP disponible que se correlaciona con el número de células y la viabilidad.
Ensayos de proliferación con colorantes fluorescentes
Etiquetado CFSE
5(6)-Diacetato de carboxifluoresceína éster N-succinimidílico (CFSE) es una opción popular para medir el número de divisiones experimentadas por una población celular. Al entrar en la célula, las esterasas intracelulares escinden el CFSE para formar el compuesto fluorescente y el grupo succinimidil éster reacciona covalentemente con las aminas primarias de las proteínas intracelulares. Tras la división, la intensidad de fluorescencia de cada célula hija se reduce a la mitad, lo que permite una detección sencilla del número de divisiones celulares mediante citometría de flujo. La CFSE se ha utilizado ampliamente para medir la proliferación de linfocitos, incluidas las células T.
Tinción doble de células vivas/muertas
Tinción doble de células vivas/muertas
Puede utilizarse para la detección simultánea por fluorescencia de células viables y muertas. Calcein-AM es un colorante altamente lipofílico y permeable a la membrana celular. Aunque la Calceína-AM en sí no es una molécula fluorescente, la calceína generada a partir de la Calceína-AM por la esterasa en una célula viable emite una fuerte fluorescencia verde (λex 490 nm, λem 515 nm). Por lo tanto, la Calceína-AM sólo tiñe las células viables. En cambio, el colorante que tiñe el núcleo Yoduro de propidio no puede atravesar la membrana de una célula viable. Llega al núcleo atravesando zonas desordenadas de la membrana celular muerta, e intercala con la doble hélice de ADN para emitir fluorescencia roja (λex 535 nm, λem 617 nm). Dado que tanto la calceína como el PI-ADN pueden excitarse con luz de 490 nm, es posible la monitorización simultánea de células viables y muertas con un microscopio de fluorescencia de excitación única.
Calceína y PI-ADN.
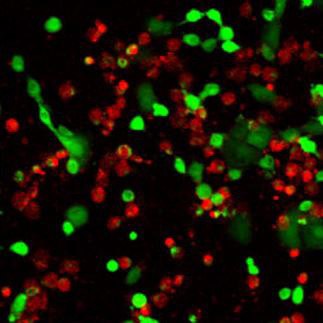
Figura 5.Doble tinción de células vivas/muertas
Cultivos celulares 3D - Triple tinción de células vivas/muertas/totales
El Cell Viability Imaging Kit es un ensayo de tres colores que puede utilizarse con cultivos celulares 2D y 3D para la tinción de fluorescencia simultánea de células viables (Calcein-AM), células muertas (Propidium Iodide/PI), así como células totales (Hoechst 33342).
- Calceína-AM
- Calceína-AM
- Calceína-AM
- Fluye en verde al unirse al calcio, dependiendo de la actividad de la esterasa presente sólo en células viables metabólicamente activas.
- Yoduro de propidio (PI) es un colorante nuclear que es excluido por la membrana de las células vivas, pero atraviesa la membrana dañada de las células muertas, intercalándose con el ADN para emitir una fuerte fluorescencia roja.
- Hoechst 33342 es un colorante de tinción de ADN que presenta una baja citotoxicidad. Presenta una fluorescencia azul y se utiliza como indicador del recuento total de células.
- Calceína-AM
- Calceína-AM
Cuento de células con Trypan Blue
Trypan Blue es una de las diversas tinciones recomendadas para su uso en procedimientos de exclusión de colorantes para el recuento de células viables. Este método se basa en el principio de que las células vivas (viables) no absorben el colorante azul, mientras que las células muertas (no viables) sí lo hacen. La viabilidad celular puede calcularse mediante la relación total de células vivas/total de células (vivas y muertas). La tinción también facilita la visualización de la morfología celular global.
NOTA: El azul tripán tiene mayor afinidad por las proteínas séricas que por las proteínas celulares. Si el fondo es demasiado oscuro debido a la presencia de suero en la matriz, las células deben ser pelleteadas y resuspendidas en medio libre de proteínas o solución salina antes del recuento.
Preparación de la tinción con azul tripán.
Productos relacionados
Referencias
Para seguir leyendo, inicie sesión o cree una cuenta.
¿No tiene una cuenta?