Synthèse de peptides
Un peptide est constitué d'au moins deux acides aminés reliés par une liaison amide, formant une chaîne d'acides aminés généralement longue de 2 à 70 acides aminés. Les peptides se distinguent des protéines en ce qu'ils n'ont pas besoin d'être repliés pour exercer leur activité biologique. Les peptides sont présents de manière endogène sous forme d'hormones peptidiques, telles que l'angiotensine, la LHRH, l'enképhaline, et sous forme de toxines dans les plantes et les animaux. Les peptides présentent un grand intérêt en tant que composés phares pour la découverte de médicaments et en tant que médicaments à part entière. Ils trouvent également des applications dans les vaccins, les biomatériaux, les sondes histologiques et sont utilisés en grand nombre comme antigènes pour générer des anticorps.
Les peptides sont synthétisés chimiquement soit en solution, soit en phase solide. Le processus implique la formation dirigée et sélective d'une liaison amide entre un acide aminé N-protégé et un acide aminé portant un groupe amino libre et un acide carboxylique protégé. Dans la synthèse en phase solide, le groupe protecteur carboxyle est lié à un support polymère. Après la formation de la liaison, le groupe protecteur de l'amino du dipeptide est éliminé et l'acide aminé N-protégé suivant est couplé.
Catégories en vedette
Nous proposons une gamme complète d'acides aminés, de résines et de réactifs d'une qualité inégalée, notamment Novabiochem®, pour la synthèse de peptides, la chimie organique à haut débit, le marquage de peptides et les produits fabriqués sur mesure.
Nos ligands et complexes NHC stables et tolérables peuvent être utilisés comme ligands auxiliaires efficaces pour faciliter votre travail dans le domaine de la catalyse organométallique et de la recherche en chimie catalytique.
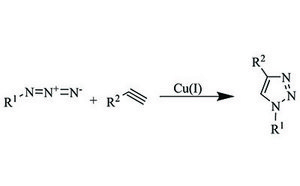
Notre gamme de réactifs pour la chimie par clic comprend divers azides, alcynes, catalyseurs et ligands qui vous permettront d'accélérer vos progrès dans les domaines de la biologie chimique, de la chimie des polymères, de la bioconjugaison et de la découverte de médicaments.
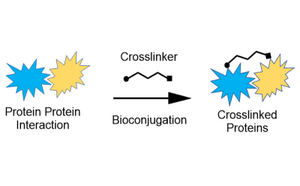
Notre gamme de lieurs et de réticulants assure la stabilité structurelle et la fiabilité des interactions protéine-protéine, protéine-peptide et peptide/protéine-petite molécule pour tous vos besoins en matière de bioconjugaison.
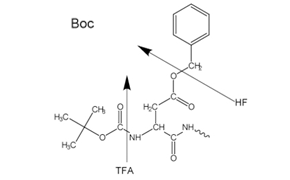
Figure 2Side-chain protecting groups for Boc solid-phase peptide synthesis (SPPS)
La synthèse peptidique en phase solide (SSPS) est la méthode de synthèse peptidique la plus fréquemment utilisée en raison de son efficacité, de sa simplicité, de sa rapidité et de sa facilité de parallélisation. La SPPS consiste à ajouter séquentiellement des résidus d'acides aminés protégés au niveau de la chaîne latérale et de l'amino à un acide aminé ou un peptide fixé à un support polymère insoluble (figure 1).
Un groupe Boc labile en milieu acide (Boc SPPS) ou un groupe Fmoc labile en milieu basique (Fmoc SPPS) est utilisé pour la protection N-α. Après élimination de ce groupe protecteur, l'acide aminé protégé suivant est ajouté à l'aide d'un réactif de couplage ou d'un dérivé d'acide aminé protégé préactivé. L'acide aminé C-terminal est ancré à la résine via un lieur, dont la nature détermine les conditions requises pour libérer le peptide du support après l'extension de la chaîne. Les groupes protecteurs de la chaîne latérale sont souvent choisis de manière à être clivés simultanément avec le détachement du peptide de la résine (Figures 2 et 3).
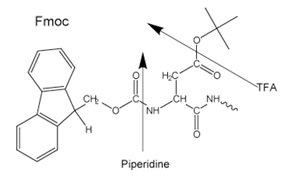
Figure 3.Side-chain protecting groups for Fmoc solid-phase peptide synthesis (SPPS)
La plupart des peptides sont préparés selon la méthode Fmoc, car le clivage final et la déprotection sont effectués par traitement à l'acide trifluoroacétique, contrairement à la méthode Boc qui nécessite l'utilisation d'HF anhydre liquide hautement toxique et corrosif dans un équipement spécialisé.
Des peptides de 50 acides aminés peuvent être préparés de manière routinière, bien que la synthèse de protéines de plus de 100 acides aminés soit couramment rapportée. Des protéines plus longues peuvent être produites par ligature chimique native de peptides entièrement déprotégés en solution. Cette méthode permet de synthétiser des peptides naturels difficiles à exprimer dans des bactéries, d'incorporer des acides aminés non naturels ou D-aminoacides, et de générer des peptides cycliques, ramifiés, marqués et modifiés post-traductionnellement.
La synthèse de peptides en phase liquide, qui utilise généralement la protection Boc ou Z-amino, a été remplacée par la synthèse de peptides en phase solide, à l'exception des processus existants de synthèse à grande échelle de peptides à des fins industrielles.
Consultez notre moteur de recherche de documents pour trouver des fiches techniques, des certificats et de la documentation technique.
Articles connexes
- Novabiochem® offers a wide range of linkers and derivatized resins for Fmoc solid-phase peptide synthesis with specialized protocols.
- Chromogenic and fluorogenic derivatives are invaluable tools for biochemistry, having numerous applications in enzymology, protein chemistry, immunology and histochemistry.
- Aspartimide formation 1,2 is caused by repeated exposure of aspartic acid-containing sequences to bases like piperidine and can result ultimately in the generation of 9 different by-products.
- Novabiochem® offers polymer supports for solid phase peptide synthesis, suitable for various peptide lengths and sequences.
- Long peptide purification removes impurities effectively, crucial for research and pharmaceutical applications.
- Tout voir (12)
Protocoles associés
- A guide to create solvent systems used for the thin-layer chromatography assay of Novabiochem products.
- Overcome challenges in synthesis and disulfide bond formation with protocols for Fmoc solid-phase peptide synthesis of peptides with cysteine and methionine.
- We provide an overview of our available reagents, together with recommendations and details of their use for synthesis of peptides containing post-translationally modified amino acids.
- Anhydrous HF is the preferred reagent for peptide cleavage from Boc-based resins, versatile and effective for various peptide synthesis.
- Fmoc resin cleavage and deprotection are crucial steps for peptide synthesis, yielding the desired peptide after resin detachment.
- Tout voir (7)
Trouver d'autres articles et protocoles
Comment pouvons-nous vous aider ?
Si vous avez des questions, veuillez envoyer une demande d'assistance clientèle
ou contactez notre service clientèle :
Envoyez un e-mail à custserv@sial.com
ou appelez le +1 (800) 244-1173
Assistance supplémentaire
- Chromatogram Search
Use the Chromatogram Search to identify unknown compounds in your sample.
- Calculateurs et Applis
Boîte à outils disponible sur Internet - Outils et ressources pour la recherche scientifique en chimie analytique, sciences de la vie, synthèse chimique et science des matériaux.
- Customer Support Request
Support client, y compris l'aide pour les commandes, les produits, les comptes et les problèmes techniques du site Web.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?