Essais de viabilité cellulaire et de prolifération
- DNA Synthesis Proliferation Assays
- Essais de viabilité cellulaire par luminescence
- Essais de prolifération par colorant fluorescent
- Essais de prolifération par colorant fluorescent
- Culture cellulaire 3D - Triple coloration des cellules vivantes/mortes/totales
- Dénombrement des cellules au bleu Trypan
Les tests de viabilité cellulaire
Les tests d'immunité des cellules/ul>
Introduction
Les essais visant à mesurer la prolifération cellulaire, la viabilité cellulaire et la cytotoxicité sont couramment utilisés pour surveiller la réponse et la santé des cellules en culture après un traitement par divers stimuli. Le choix d'une méthode d'essai dépend du nombre et du type de cellules utilisées ainsi que du résultat escompté. Les tests de prolifération cellulaire peuvent contrôler le nombre de cellules dans le temps, le nombre de divisions cellulaires, l'activité métabolique ou la synthèse de l'ADN. Le comptage des cellules à l'aide de colorants de viabilité tels que le bleu trypan ou la Calcéine-AM peut fournir à la fois le taux de prolifération et le pourcentage de cellules viables.
Aperçu des tests de viabilité et de prolifération cellulaires
Aperçu des tests de viabilité et de prolifération cellulaires
.
Les tests d'immunité des cellules/ul>
Introduction
Les essais visant à mesurer la prolifération cellulaire, la viabilité cellulaire et la cytotoxicité sont couramment utilisés pour surveiller la réponse et la santé des cellules en culture après un traitement par divers stimuli. Le choix d'une méthode d'essai dépend du nombre et du type de cellules utilisées ainsi que du résultat escompté. Les tests de prolifération cellulaire peuvent contrôler le nombre de cellules dans le temps, le nombre de divisions cellulaires, l'activité métabolique ou la synthèse de l'ADN. Le comptage des cellules à l'aide de colorants de viabilité tels que le bleu trypan ou la Calcéine-AM peut fournir à la fois le taux de prolifération et le pourcentage de cellules viables.
Aperçu des tests de viabilité et de prolifération cellulaires
Aperçu des tests de viabilité et de prolifération cellulaires
.
Tests de prolifération par synthèse d'ADN
Test de prolifération cellulaire BrdU<
La prolifération cellulaire peut être étudiée en contrôlant l'incorporation d'un radio-isotope, la [3H]-thymidine, dans l'ADN cellulaire, suivie d'une autoradiographie. On peut également utiliser le 5-bromo-2′-désoxy-uridine (tests BrdU) à la place de la thymidine. Les cellules qui ont incorporé le BrdU dans leur ADN sont facilement détectées à l'aide d'un anticorps monoclonal contre le BrdU et d'un anticorps secondaire conjugué à une enzyme ou à un fluorochrome.

Figure 1.A, Cellules en prolifération dans l'œil d'un embryon de poussin E4 par coloration au BrdU B, Validation de l'anticorps anti-BrdU par la camptothécine. En traitant les cellules Jurkat avec l'agent d'arrêt du cycle cellulaire camptothécine, les cellules circulantes sont piégées à la transition de phase G1/S.
Essais de prolifération EdU
Les essais de prolifération Baseclick EdU constituent une méthode efficace pour la détection par fluorescence de l'ADN en cours de réplication. Le nucléoside EdU modifié est ajouté aux cellules vivantes et est incorporé dans l'ADN en cours de réplication. La chimie click induite par le Cu permet de fixer rapidement des sondes fluorescentes à l'EdU. Il s'agit d'un moyen quantitatif de surveiller les cellules qui prolifèrent. Les tests sont disponibles dans différents formats pour l'imagerie microscopique, la cytométrie de flux, le criblage à haut débit et les expériences in vivo. Quatre sondes fluorescentes différentes avec des pics d'excitation de 488, 555, 594 et 647 sont disponibles pour une capacité de multiplexage avec d'autres sondes fluorescentes.
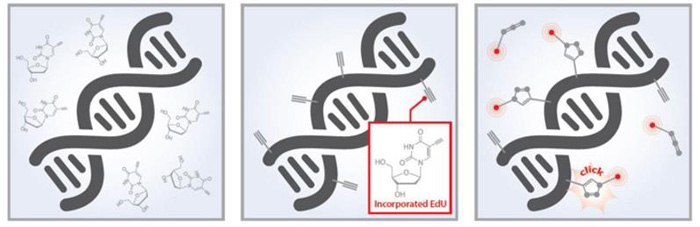
Figure 2.Les kits de prolifération cellulaire Edu-Click incorporent l'EdU (5-éthynyl-2'-désoxyuridine) dans l'ADN pendant la synthèse active de l'ADN et sont mesurés à l'aide d'une méthode de détection fluorescente par chimie click.
Tests de prolifération métabolique
Les tests qui mesurent l'activité métabolique conviennent à l'analyse de la prolifération, de la viabilité et de la cytotoxicité. La réduction des sels de tétrazolium tels que MTT, XTT, et XTT.XTT, et WST-1 en composés formazan colorés ou la bioréduction de la résazurine ne se produit que dans les cellules métaboliquement actives. Les cellules en prolifération active augmentent leur activité métabolique, tandis que les cellules exposées à des toxines ont une activité réduite.
Essais de prolifération cellulaire au MTT
Le MTT ;(3-[4,5-diméthylthiazol-2-yl]-2,5- diphényltétrazolium bromure ; bleu de thiazolyle) est un sel de tétrazolium soluble dans l'eau qui donne une solution jaunâtre lorsqu'il est préparé dans des milieux ou des solutions salines dépourvus de rouge de phénol. Le MTT dissous est converti en un formazan violet insoluble par clivage de l'anneau de tétrazolium par des enzymes déshydrogénases. Ce formazan insoluble dans l'eau peut être solubilisé à l'aide d'isopropanol ou d'autres solvants, et la matière dissoute est mesurée par spectrophotométrie en utilisant l'absorbance en fonction de la concentration du colorant converti.
Essais de prolifération cellulaire au XTT
Contrairement au MTT, le produit de clivage du XTT est soluble dans l'eau ; une étape de solubilisation n'est donc pas nécessaire. Le sel de tétrazolium XTT est scindé en formazan par un mécanisme cellulaire complexe. Cette bioréduction se produit uniquement dans les cellules viables et est liée à la production de NAD(P)H par la glycolyse. La quantité de colorant formazan formé est directement liée au nombre de cellules métaboliquement actives dans la culture.
Essais de prolifération cellulaire WST-1
Le sel de tétrazolium stable WST-1 est scindé en un formazan soluble par un mécanisme cellulaire complexe qui se produit principalement à la surface de la cellule. Cette bioréduction dépend largement de la production glycolytique de NAD(P)H dans les cellules viables. La quantité de colorant formazan formé est directement corrélée au nombre de cellules métaboliquement actives dans la culture.
Guide du protocole : WST-1 Assay pour la viabilité et la prolifération cellulaires. Protocoles, foire aux questions et dépannage
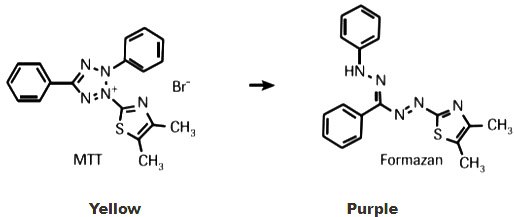
Figure 3.Le test MTT est un test colorimétrique permettant d'évaluer la prolifération cellulaire sur la base de l'activité métabolique. Les enzymes oxydoréductases cellulaires dépendantes du NAD(P)H reflètent le nombre de cellules viables présentes. Ces enzymes sont capables de réduire le colorant tétrazolium jaune MTT, le bromure de 3-(4,5-diméthylthiazol-2-yl)-2,5-diphényltétrazolium, en un formazan insoluble de couleur violette.
Tests de viabilité cellulaire par luminescence
L'ATP étant un indicateur de cellules métaboliquement actives, le nombre de cellules viables peut être évalué sur la base de la quantité d'ATP disponible. Le test ATP Cell Viability Luciferase Assay offre un test homogène très sensible pour quantifier l'ATP dans les cultures cellulaires. Ce kit utilise la luciférase de la luciole pour oxyder la D-Luciférine et la production de lumière qui en résulte pour évaluer la quantité d'ATP disponible dans les cultures cellulaires. La procédure d'essai sensible implique une seule addition du cocktail de détection de l'ATP directement aux cellules cultivées dans un milieu supplémenté en sérum. Il n'est pas nécessaire de laver les cellules, d'enlever le milieu ou de procéder à de multiples pipetages. Le kit est suffisamment sensible pour détecter une seule cellule ou 0,01 picomoles d'ATP. Le signal produit est linéaire dans les six ordres de grandeur. En reliant la quantité d'ATP au nombre de cellules viables, le test a de nombreuses applications, allant de la détermination du nombre de cellules viables à la prolifération cellulaire en passant par la cytotoxicité cellulaire.
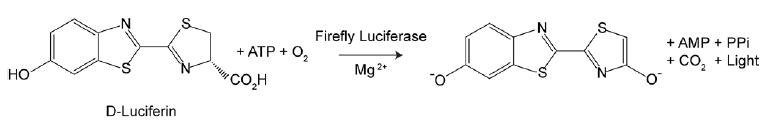
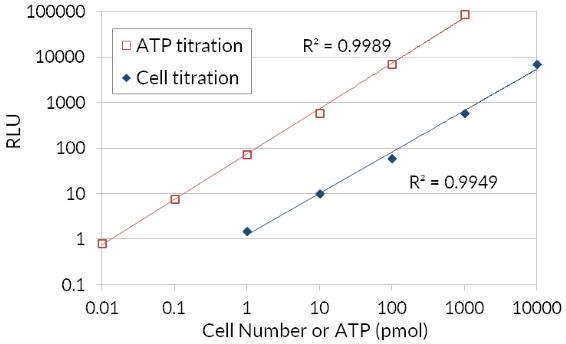
Figure 4.Test de viabilité cellulaire à l'ATP luciférase bioluminescente. L'utilisation par la luciférase de l'ATP pour oxyder la D-Luciférine et la production de lumière qui en résulte permettent d'évaluer la quantité d'ATP disponible en corrélation avec le nombre et la viabilité des cellules.
Tests de prolifération avec colorant fluorescent
Marquage CFSE
Carboxyfluorescein diacetate N-succinimidyl ester (CFSE)/product/sigma/21888">5(6)-Carboxyfluorescein diacetate N-succinimidyl ester (CFSE) est un choix populaire pour mesurer le nombre de divisions subies par une population cellulaire. Lorsqu'il pénètre dans la cellule, le CFSE est clivé par des estérases intracellulaires pour former le composé fluorescent et le groupe ester de succinimidyle réagit de manière covalente avec des amines primaires sur les protéines intracellulaires. Lors de la division, l'intensité de la fluorescence de chaque cellule fille est réduite de moitié ce qui permet une détection simple du nombre de divisions cellulaires par cytométrie de flux. La CFSE a été largement utilisée pour mesurer la prolifération des lymphocytes, y compris les cellules T.
Double coloration des cellules vivantes/mortes
Double coloration des cellules vivantes/mortes peut être utilisée pour la détection simultanée par fluorescence des cellules viables et des cellules mortes.Calcein-AM est un colorant hautement lipophile et perméable à la membrane cellulaire. Bien que la calcéine-AM elle-même ne soit pas une molécule fluorescente, la calcéine générée à partir de la calcéine-AM par l'estérase dans une cellule viable émet une forte fluorescence verte (λex 490 nm, λem 515 nm). La calcéine-AM ne colore donc que les cellules viables. En revanche, le colorant qui colore le noyau Iodine de propidium ne peut pas traverser la membrane d'une cellule viable. Elle atteint le noyau en traversant des zones désordonnées de la membrane cellulaire morte et s'intercale avec la double hélice d'ADN pour émettre une fluorescence rouge (λex 535 nm, λem 617 nm). Comme la calcéine et l'ADN-PI peuvent être excités par une lumière de 490 nm, il est possible de surveiller simultanément les cellules viables et mortes à l'aide d'un microscope à fluorescence à excitation unique.
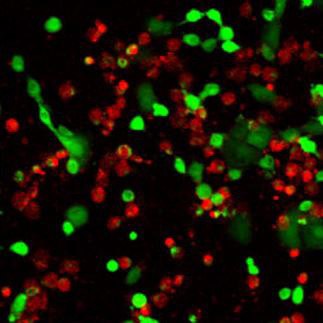
Figure 5.Double coloration des cellules vivantes/mortes
Culture cellulaire 3D - Triple coloration des cellules vivantes/mortes/totales
Le Kit d'imagerie de la viabilité cellulaire est un test à trois couleurs qui peut être utilisé avec des cultures cellulaires 2D et 3D pour la coloration simultanée par fluorescence des cellules viables (Calcein-AM), des cellules mortes (Iodure de Propidium/PI), ainsi que des cellules totales (Hoechst 33342).
- Calcéine-AM fluorescent en vert en se liant au calcium, en s'appuyant sur l'activité estérase présente uniquement dans les cellules viables métaboliquement actives.
- Iodure de propidium ;(PI) est un colorant nucléaire qui est exclu par la membrane des cellules vivantes, mais qui traverse la membrane endommagée des cellules mortes, s'intercalant avec l'ADN pour émettre une forte fluorescence rouge.
- Hoechst 33342 est un colorant de coloration de l'ADN qui présente une faible cytotoxicité. Il est fluorescent en bleu et est utilisé comme indicateur du nombre total de cellules.
Comptage des cellules au bleu trypan
Le bleu trypan est l'un des colorants recommandés pour les procédures d'exclusion de colorant pour le comptage des cellules viables. Cette méthode repose sur le principe selon lequel les cellules vivantes (viables) n'absorbent pas le colorant bleu, contrairement aux cellules mortes (non viables). La viabilité cellulaire peut être calculée en utilisant le rapport entre le nombre total de cellules vivantes et le nombre total de cellules (vivantes et mortes). La coloration facilite également la visualisation de la morphologie cellulaire globale.
NOTE : le bleu trypan a une plus grande affinité pour les protéines sériques que pour les protéines cellulaires. Si le fond est trop sombre en raison de la présence de sérum dans la matrice, les cellules doivent être culottées et remises en suspension dans un milieu sans protéines ou une solution saline avant le comptage.
Produits apparentés
Références
Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?