Analyse des extractibles PFAS dans les produits de filtration à l'aide de la norme EPA 537.1 modifiée
Aperçu des sections
- Contaminants dans les tests PFAS<./li>
- Testing Millex® PES, ; Nylon, and MCE Syringe Filters With Water Samples Using Modified EPA 537.1
- Testing Millipore® Polypropylene, PES, and MCE Cut Disc Filter Membranes With Water Samples Using Modified EPA 537.1
- Considérations sur les filtres pour la préparation des échantillons de PFAS
- Produits de filtration recommandés
Contaminants dans les tests PFAS<
Une considération essentielle pour toute méthode d'analyse des PFAS est d'éviter la contamination qui peut avoir un impact sur la précision des données, y compris celles provenant des techniques de préparation des échantillons telles que filtration. Actuellement, la plupart des méthodes d'analyse des PFAS sont destinées à des matrices "propres", telles que l'eau potable, et ne nécessitent souvent pas de filtration dans le cadre de la préparation de l'échantillon. Cependant, des méthodes telles que la méthode SW-846 8327, ASTM D7968, ASTM D7979, EPA 1633, ASTM D8421 et ISO 21675 impliquent des matrices qui peuvent contenir un degré plus élevé de particules, telles que les eaux usées. Les particules en solution doivent être éliminées avant la LC-MS/MS, car elles peuvent nuire à l'analyse d'échantillons, l'analyse d'échantillons.a href="/technical-documents/technical-article/analytical-chemistry/small-molecule-hplc/hplc-filtration-performance-optimizing">longévité des colonnes, la qualité des données obtenues et le fonctionnement général de l'instrument. Ces méthodes identifient le besoin de filtration à l'aide de membranes dans un format de filtre à seringue.
Une méthode EPA 537.1 a été utilisée pour démontrer que Filtres à seringue Millex® en polyéthersulfone (PES), nylon et esters mixtes de cellulose (MCE) ainsi que& nbsp;filtres à seringue Millexnbsp;Millipore® polypropylène, PES, et MCE cut disc filter membranes ne présentent pas de niveaux détectables de contaminants PFAS résultant des extractibles fluorés.
Test des filtres à seringue Millex® PES, MCE et Nylon avec des échantillons d'eau en utilisant l'EPA 537 modifiée.1
Matériaux et méthodes
Trois lots de PES, trois lots de nylon, deux lots de nylon-HPF (membrane en nylon avec un préfiltre en fibre de verre pour la filtration des particules), et des lots uniques de filtres à seringue Millex® MCE ont été testés pour les extractibles PFAS conformément à la méthode EPA 537.1. Certains composés PFAS non requis par la méthode, y compris les composés PFAS de nouvelle génération et les sulfonates de fluorotélomère, ont également été inclus. La méthode EPA 537.1 n'exige pas la filtration de l'échantillon, mais la filtration a été utilisée pour fournir un échantillon propre afin de tester les niveaux de contamination extractible du filtre de la seringue.
Une vue d'ensemble de la méthode modifiée EPA 537.1 utilisant des étalons internes est décrite dans le flux de travail ci-dessous, avec les conditions LC-MS/MS dans le Tableau 1. Les tests ont été réalisés en collaboration avec SGS North America dans ses installations d'Orlando, en Floride. En bref, un échantillon de 250 ml d'eau DI exempte de PFAS a été dopé avec des substituts. L'étalon interne de 0,08 ppb a été utilisé pour les blancs de contrôle de qualité. Pour déterminer si le support de filtration de l'échantillon contribue à la contamination par les PFAS, l'ensemble de l'échantillon a été passé à travers le filtre et dans une cartouche SPE en styrène divinylbenzène (SDVB). Les bouteilles et les tubes d'échantillon ont été rincés avec du méthanol basique et sont également passés à travers le filtre et dans la cartouche. L'ensemble de l'échantillon a ensuite été soumis à une SPE et concentré à 1 ml dans 96:4% (v/v) de méthanol:eau avant d'être analysé par LC-MS/MS à l'aide d'une colonne C18. L'analyse a été réalisée à l'aide d'étalons internes. Des étalons marqués au C13 ont été utilisés dans cette étude. Les filtres testés comprenaient :
- Trois lots de filtres à seringue Millex®-GP (non stériles, filtre de 33 mm avec membrane PES Millipore Express® PLUS) à la fois de 0.22 µm (N° de cat. SLGP033N) et 0.45 µm (n° de cat. SLHP033N) de pores
- Trois lots de filtres à seringue en nylon Millex® (non stériles, filtre de 33 mm avec membrane en nylon) de pores de 0.20 µm (Cat. No. SLGN033N),
- Deux lots de filtres à seringue Millex® en nylon-HPF (non stérile, filtre de 25 mm avec membrane en nylon et préfiltre en fibre de verre) en taille de pores de 0.20 µm (N° de cat. SLGNM25)
- Lots uniques de filtres à seringue Millex® MCE (non stériles, filtre de 25 mm avec membrane MCE) en 0.2 µm (N° de cat. SLGS025NB), 0,45 µm (N° de cat. SLHA025NB), et 0,8 µm (N° de cat. No. de cat. SLAA025NB), testés en trois exemplaires
Fonctionnement de la méthode utilisée pour l'EPA 537.1 modifiée:
La méthode utilisée pour l'EPA 537.1 modifiée a été testée en trois exemplaires.
Flux de travail

Filtre
Les échantillons sont filtrés à l'aide d'un filtre à seringue Millex®.
Extraction en phase solide
Les analytes sont extraits de l'échantillon par extraction en phase solide (SPE).
Les analytes sont extraits de l'échantillon par extraction en phase solide (SPE).

Concentration
Les extraits sont concentrés par évaporation à l'azote au bain-marie.
Les extraits sont concentrés par évaporation à l'azote au bain-marie.
LC-MS/MS
Les extraits concentrés sont analysés par LC-MS/MS.
Les extraits concentrés sont analysés par LC-MS/MS.
Résultats
Il n'y avait pas de contaminants PFAS détectables dans aucun des dispositifs Millex® testés à l'aide de l'EPA 537 modifiée.1 au-dessus des limites de déclaration (RL) ou des limites minimales de détection (MDL), même en tenant compte des seuils très bas de 0,0020-0,0080 ppb et 0,0010-0,0020 ppb, respectivement, selon le composé (Tableau 2). Les résultats ont été les mêmes pour les trois lots différents de membranes PES de 0,22 et 0,45 µm, les trois lots différents de membranes en nylon de 0,20 µm, les deux lots différents de membranes en nylon-HPF de 0,20 µm, et les membranes MCE de 0,2, 0,45, et 0,8 µm testées en trois exemplaires. Ces résultats suggèrent que les dispositifs de filtration PES, nylon, nylon-HPF et MCE Millex® sont fiables et appropriés pour la filtration d'échantillons d'eau en vue de l'analyse de ces composés PFAS.
aTrois dispositifs répliqués de chacun des trois lots testés, aucun composé PFAS détecté dans aucun lot au-dessus de RL ou MDL
b.Trois dispositifs répliqués de chacun des deux lots testés, aucun composé PFAS détecté dans aucun lot au-dessus de la RL ou de la MDL
cTrois dispositifs répliqués d'un lot testé, aucun composé PFAS détecté dans aucun lot au-dessus de la RL ou de la MDL
Abréviations : RL = limite de déclaration ; MDL = limite de détection minimale ; PES = polyéthersulfone ; HPF = filtre à particules élevées ; MCE = esters de cellulose mélangés ; ND = non détecté
Tableau 2. Détection des contaminants PFAS après filtration avec les dispositifs Millex® PES, nylon et MCE en utilisant la norme EPA 537.1 modifiée
.
Récupération
Dans cette étude, les tubes et les flacons d'échantillons ont été rincés avec du méthanol basique. Les taux de récupération des étalons marqués au C-13 se situaient dans la plage de contrôle de qualité acceptable pour la méthode. Toutefois, la récupération variait d'un matériau filtrant à l'autre (Figure 1) et d'un composé à l'autre. Par exemple, les dispositifs de filtrage à base de nylon ont montré des taux de récupération plus faibles que ceux à base de PES. Dans le cas des membranes en nylon, l'adsorption non spécifique des étalons et des échantillons dopés en interne peut être réduite à l'aide d'un rinçage au méthanol. Des résultats similaires ont été obtenus avec les membranes PES seules (sans boîtier et filtrées à l'aide d'un porte-filtre Swinnex® de 25 mm).
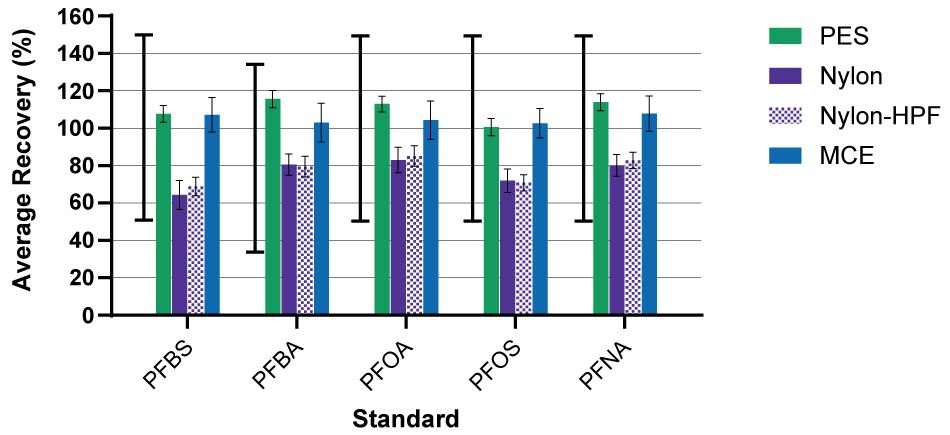
Figure 1.Le pourcentage moyen de récupération des étalons marqués au C13 pour le PFBS, le PFBA, le PFOA, le PFOS et le PFNA après filtration avec un PES de 0,22 µm (moyenne ± écart-type (STDEV), n=9 répétitions sur 3 lots), un nylon de 0.2 µm (moyenne ± écart-type, n=9 répétitions sur 3 lots), nylon-HPF 0,2 µm (moyenne ± écart-type, n=6 répétitions sur 2 lots) et MCE 0,22 µm (moyenne ± écart-type, n=3 répétitions sur 1 lot) Millex®. La plage de CQ acceptable pour la récupération des étalons internes est indiquée par la ligne noire pleine et plafonnée à gauche pour chaque composé.
Tester les membranes filtrantes Millipore® Polypropylène, PES, et MCE ; Cut Disc avec des échantillons d'eau en utilisant la norme EPA 537 modifiée.1
Les dispositifs de filtration à seringue sont le format le plus recommandé et préféré pour filtrer les échantillons en vue de l'analyse LC-MS/MS des PFAS en raison de leur facilité d'utilisation et de la gamme de petits volumes pouvant être traités (10-100 ml). Dans certains cas, cependant, les filtres à seringue ne sont pas la meilleure option pour la filtration ; par exemple, lorsqu'il n'existe pas de filtres à seringue disponibles dans le commerce qui conviennent à une application spécifique. Dans ce cas, une autre solution doit être envisagée. Un dispositif semblable à un filtre à seringue, tel qu'un support Swinnex®, est une alternative viable. Ce dispositif à pression contient n'importe quelle membrane de filtre à disque coupée d'une taille spécifique (13 mm ou 25 mm de diamètre) et fonctionne de la même manière qu'un filtre à seringue traditionnel, convertissant ainsi n'importe quel matériau de membrane en un format de filtre à seringue.
Le polypropylène est un matériau couramment préféré pour la préparation et la filtration d'échantillons. Le polypropylène est un matériau durable, compatible avec une large gamme de solvants et de températures, qui présente de faibles valeurs d'extraction, ce qui le rend particulièrement adapté à la préparation des échantillons et des phases mobiles liées aux PFAS. Le polypropylène est naturellement hydrophobe, ce qui complique la filtration des échantillons aqueux. La plupart des filtres à disque en polypropylène disponibles dans le commerce sont hydrophobes, comme les membranes filtrantes à disque coupé en polypropylène de Millipore® (Cat. No. PPTG04700 et Cat. No. PPTH04700). Bien qu'approprié pour les solvants tels que le méthanol, il peut être difficile de filtrer des échantillons aqueux. Dans quelques cas, le polypropylène peut être trouvé dans un format hydrophile (filtres à membrane en polypropylène hydrophile Millipore®, Cat. No. PPHG04700 et Cat. No. PPHH04700). Ces filtres sont adaptés à la manipulation d'échantillons aqueux. Ainsi, en réalisant le potentiel du polypropylène à être utilisé dans le contexte d'une variété de flux de travail PFAS, y compris la filtration de la phase mobile, nous avons déterminé le niveau des extractibles PFAS que ces membranes filtrantes coupées libèrent.
Matériaux et méthodes
Swinnex® Assemblage de porte-filtre
Les membranes filtrantes à disque coupé en polypropylène (PP) hydrophile et hydrophobe de Millipore® de 0.2 µm et 0,45 µm, les membranes filtrantes à disques coupés Millipore® PES de 0,22 µm et 0.45 µm, et les membranes filtrantes à disques coupés Millipore® MCE de 0,45 µm, 0,8 µm, et 5,0 µm ont été testées pour la teneur en PFAS extractibles. Des dispositifs Swinnex® (25 mm de diamètre) ont été utilisés pour convertir les différentes membranes filtrantes en un dispositif de filtration à seringue à verrouillage Luer, conformément à la figure 2. Une fois assemblé, le dispositif Swinnex® peut être connecté à une seringue Luer-lock contenant le matériau à filtrer. La filtration a ensuite été effectuée comme avec d'autres dispositifs de filtration à seringue. Pour chaque répétition de disque, un dispositif Swinnex® neuf et propre a été utilisé.

Figure 2A.Placement du joint torique
Figure 2B.Traitement des filtres

Figure 2C.Placement du filtre

Figure 2D.Fixation du joint

Figure 2E.Porte-filtre Swinnex® assemblé
Modifié EPA 537.1
Dans cette partie de l'étude, neuf types de membranes filtrantes à disque coupé de 25 mm ont été testés :
- 0,2 µm PP hydrophobe (Cat. No. PPTG02500)
- 0,45 µm PP hydrophobe (Cat. PPTH02500)
- 0.2 µm PP hydrophile (N° de cat. PPHG02500)
- 0.45 µm PP hydrophile (N° de cat. PPHH02500)
- 0,22 µm PES (Cat. GPWP02500)
- 0.45 µm PES (N° de cat. HPWP02500)
- 0.45 µm MCE (N° de cat. HAWP02500)
- 0.8 µm MCE (Cat. No. AAWP02500)
- 5.0 µm MCE (Cat. No. SMWP02500)
Une fois que chaque membrane filtrante à disque coupé a été placée solidement dans un dispositif Swinnex®, 250 ml d'échantillons d'eau enrichis de substituts ont été passés à travers chaque filtre et dans une cartouche SPE au styrène divinylbenzène (SDVB) en utilisant la norme EPA 537.1 pour les matrices d'eau potable. L'échantillon entier a été soumis à une SPE et à une concentration, conformément aux procédures décrites dans le flux de travail ci-dessus. LC-MS/MS avec une colonne C18 a été réalisée conformément aux conditions du Tableau 1 et l'analyse a été effectuée en utilisant des normes internes pour déterminer s'il y avait des niveaux d'extractibles présents dans chaque membrane de filtre à disque coupée. Un lot (n=3 filtres par lot) a été testé par type de membrane.
Il est important de noter qu'il est difficile d'écouler de l'eau pure à travers les membranes filtrantes à disque coupé en PP hydrophobe ; ainsi, pour améliorer l'écoulement de l'eau pour ces échantillons, les membranes filtrantes à disque coupé ont été pré-mouillées dans du méthanol avant de filtrer 250 mL d'eau. Il n'a pas été nécessaire de pré-mouiller les membranes filtrantes à disque coupé en PP hydrophile.
Résultats
Comme pour les dispositifs de filtration à seringue Millex®, il n'y avait pas de contaminants PFAS détectables dans les membranes filtrantes à disque coupé en polypropylène, PES ou MCE conformément à la norme EPA 537 modifiée.1 au-dessus de la LR, allant de 0,0020 à 0,0080 ppb, ou de la LDM, allant de 0,0010 à 0,0020 ppb (Tableau 3). Cela indique que ces membranes ne présentent pas de substances extractibles de PFAS à ces limites et qu'elles pourraient être utilisées pour des applications de PFAS où la filtration est nécessaire pour la préparation des échantillons.
Cependant, pour les seules membranes filtrantes à disques coupés en polypropylène hydrophobe, il y avait quatre composés (acide perfluoro-n-dodécanoïque (PFDoDA), acide perfluoro-n-tridécanoïque (PFTrDA), acide perfluoro-n-tétradécanoïque (PFTeDA) et acide N-éthyl perfluorooctanesulfonamidoacétique (N-EtFOSAA)) pour lesquels il n'y avait pas de composés PFAS détectables, mais les normes associées de 13C2-PFDoA, 13C2-PFTeDA et D5-NEtFOSAA, ont montré des taux de récupération en dehors des limites de contrôle de 40-140 %, 30-130 % et 40-140 %, respectivement. Ces composés ont présenté des taux de récupération moyens d'environ 15-25 % (pour le PFDoDA, le PFTrDA et le PFTeDA) et de 30-33 % (pour le N-EtFOSAA). Cela indique que l'adsorption non spécifique de ces composés sur le polypropylène hydrophobe pourrait être importante dans l'eau. Compte tenu de la longueur des chaînes et des groupes fonctionnels volumineux de ces composés, il existe un potentiel d'interactions hydrophobes et stériques avec les milieux de filtration et d'autres consommables. Il est intéressant de noter que les récupérations du polypropylène hydrophile sont restées dans les limites de contrôle pour tous les composés, ce qui indique que l'hydrophilisation du matériau de la membrane a réduit les interactions non spécifiques avec les normes PFAS.
aTrois dispositifs répliqués par lot testé, trois lots par numéro de catalogue testé
bTrois dispositifs répliqués par lot testé, deux lots par numéro de catalogue testé
cTrois dispositifs répliqués par lot testé, un lot par numéro de catalogue testé
dNorme d'identification associée en dehors des limites de contrôle pour les trois dispositifs testés ; 13C2-PFDoDA, 13C2-PFTeDA, d5-EtFOSAA
Abréviations : RL = limite de déclaration ; MDL = limite minimale de détection ; PP = polypropylène ; philic = hydrophile ; phobic = hydrophobe ; PES = polyéthersulfone ; MCE = esters mixtes de cellulose ; ND = non détecté
Tableau 3. Détection des contaminants PFAS dans l'eau après filtration avec des filtres hydrophobes de 0.2 µm et 0,45 µm, le polypropylène hydrophile 0,2 µm et 0,45 µm, le PES 0,22 µm et 0,45 µm, et les PES 0.45 µm, 0,8 µm, et 5,0 µm MCE cut disc filter membranes in Swinnex® devices using modified EPA 537.1.
L'utilisation de ces membranes dans les dispositifs Swinnex® a permis d'améliorer la qualité de l'eau et de réduire les risques de contamination.
Récupération
Membranes de polypropylène hydrophobes ou hydrophiles
Dans les échantillons d'eau, les membranes filtrantes à disques coupés en polypropylène hydrophobes ont montré une récupération des étalons internes dans la fourchette de contrôle de qualité.Dans les échantillons d'eau, les membranes filtrantes à disque en polypropylène hydrophile testées ont montré une récupération des étalons internes dans la plage de CQ, alors que les membranes filtrantes à disque en coupe hydrophobe ne l'ont pas fait (Figure 3). Les taux de récupération pour 13C2-PFDoDA, 13C2-PFTeDA et D5-EtFOSAA ont systématiquement montré une récupération en dehors de la plage de contrôle de qualité pour le polypropylène hydrophobe, ce qui rend difficile la quantification de la teneur réelle en PFAS pour ces composés. Étant donné que le PFDoDA, le PFTeDA et le PFTrDA sont des molécules PFCA à longue chaîne, la perte observée peut être due à l'encombrement stérique et aux interactions hydrophobes avec le matériau de la membrane ou le matériau du boîtier Swinnex®.
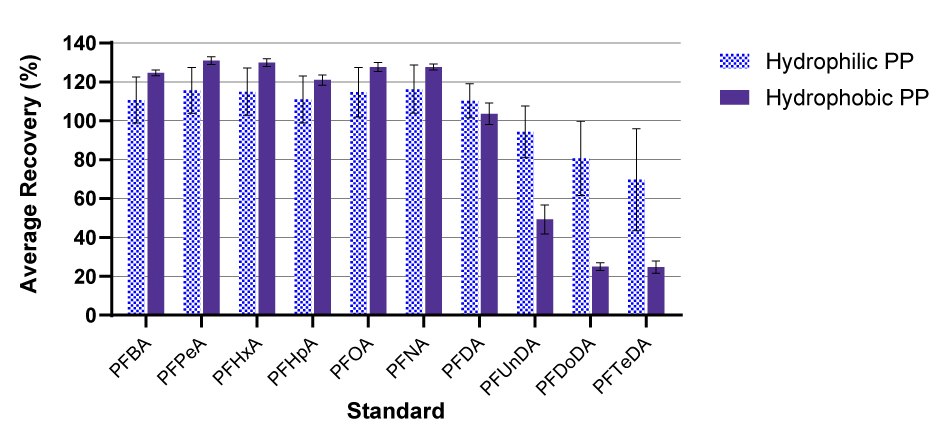
Figure 3.Pourcentage moyen de récupération des étalons marqués au C-13 pour les filtres à membrane à disques coupés en polypropylène hydrophiles par rapport aux filtres hydrophobes dans l'eau, pour la classe des acides perfluoroalkyl carboxyliques des PFAS uniquement. Les valeurs sont des moyennes ± écart-type, n=3 répétitions. La plage de CQ pour les étalons varie selon le composé, de gauche à droite : 35-135 % (13C4-PFBA), 50-150 % (13C5-PFPeA à travers 13C6-PFDA), 40-140% (13C2-PFDoDA), 30-130% (13C2-PFTeDA).
Membranes PES et MCE
Les taux de récupération de tous les étalons marqués au 13C se situaient dans la plage de contrôle de qualité acceptable pour la méthode lors de l'utilisation de membranes filtrantes MCE et PES à disque coupé de 0,45 µm. Cependant, la récupération variait légèrement en fonction du matériau filtrant et du composé (Figure 4). Par exemple, les filtres PES de 0,45 µm, qu'il s'agisse de filtres à seringue ou de membranes filtrantes à disques coupés, ont montré des taux de récupération généralement plus élevés pour presque tous les composés PFAS testés par rapport au MCE. La plus grande différence de récupération, toutes conditions confondues, a été observée avec le PFOSA, pour lequel les PES ont montré une récupération de 108 à 120 % par rapport au MCE qui était considérablement plus faible (toujours dans la plage de contrôle de qualité), avec une récupération de 36 à 60 %.

Figure 4.Le pourcentage moyen de récupération des normes PFAS marquées au 13C après filtration avec des membranes filtrantes à disques coupés Millipore® de 0,45 µm (moyenne ± écart-type, n=3 répétitions).
Considérations sur les filtres pour la préparation des échantillons de PFAS
Le choix d'un filtre pour une méthode d'analyse particulière comporte de nombreuses considérations. Les filtres doivent être compatibles avec l'échantillon et les composants chimiques, présenter de faibles niveaux d'extractibles susceptibles d'interférer avec l'interprétation des données, et permettre une récupération élevée de l'analyte d'intérêt. Pour les méthodes d'analyse des PFAS, il est nécessaire d'examiner attentivement le matériau du filtre, la taille des pores, le format, le fabricant et les paramètres de la méthode afin d'obtenir les meilleures performances du filtre. Ces données montrent que les filtres à seringue Millex® PES, nylon, nylon-HPF et MCE ainsi que les membranes de filtre à disque Millipore® en polypropylène hydrophile, polypropylène hydrophobe, PES et MCE maintiennent des taux élevés de récupération des PFAS et ne présentent pas de niveaux de contamination par les PFAS, et peuvent donc être utilisés dans les méthodes de test des PFAS.
Filtres à seringue recommandés
Filtres à membrane à disques coupés recommandés
Porte-filtres recommandés
Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?