Acides boroniques et dérivés
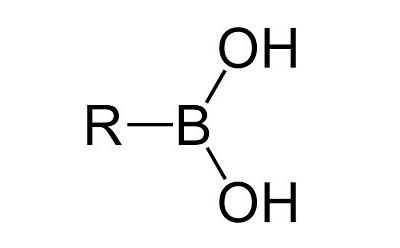
Les acides boroniques et les dérivés d'acide boronique jouent un rôle important en synthèse organique et en chimie m&édicinale.eacute;dicinale, du fait de leur polyvalence comme interméacute;diaires de synthégrave;se dans la préacute;paration de molécules complexes. Nous avons le plaisir de vous proposer une gamme complève;te d'acides boroniques destinée aux réactions de synthèse, notamment la réaction de couplage croiséacute ; de Suzuki-Miyaura catalysé ;e par le palladium qui permet de former des liaisons carbone-carbone, le couplage de Stille, le couplage de Sonogashira, le couplage de Chan-Lam, le couplage de Lieberskind-Strogl, les additions conjuguées, les homologations et les réarrangements allyliques électrophiles.
Les acides boroniques sont également utilisés dans les applications biologiques, par exemple pour l'inhibition des protéacute;ases à ; sérine. Le groupe Raines a menéacute ; des recherches approfondies sur les acides boroniques latéraux améacute;liorant l'administration cytosolique d'une toxine prot&éinique, par la'administration cytosolique d'une toxine prot&éinique.eacute;inique, par la formation d'esters de boronate avec les 1,2 et 1,3-diols de saccharides, tels que ceux qui recouvrent la surface des cellules de mammifères.
Pour en savoir plus :
Acides alcényliques et alkylés
<.a href="#Boronate-Esters">Esters de boronate
Les sels de trifluoroburate peuvent être utilisés pour la fabrication de sels.
Products
Ressources produits apparentées
- MIDA Boronates
MIDA-protected boronate esters offer stability, chromatography compatibility, and reactivity in anhydrous cross-coupling conditions.
- Potassium Trifluoroborate Salts
Potassium trifluoroborates are moisture- and air-stable organoboron reagents suitable for oxidative conditions.
- Potassium Organotrifluoroborates
Bench-stable Potassium Organotrifluoroborates enable diverse C-C bond formation reactions.
Acides alcényliques et alkylés
Les acides alcé ;nyliques et alkylés sont des acides boriques substitués comportant une liaison carbone-bore, de formule R–B(OH)2. Ces acides de Lewis sont des composéacute;s "verts" ; du fait de leur faible toxicitéacute ; inhérente et de leur dégradation rapide dans l'environnement. Nous fournissons des acides alcényliques et des acides alkylés de grande qualité ; destinés à ; la formation de dérivés d'acide boronique et à ; d'autres applications de synthèse chimique.
Acides arylboroniques
La plupart des acides arylboroniques peuvent être facilement déshydratés pour donner un anhydride cyclique (trimère). Notre sélection d'acides arylboroniques peut contenir des quantitéacute;s variables de cet anhydride cyclique. Heureusement, l'acide et l'anhydride fonctionnent tout aussi bien l'un que l'autre dans les réactions de couplage de Suzuki. C'est pourquoi les deux formes sont géacute;néralement considéacute;rées comme équivalentes. Nous proposons une vaste gamme d'acides arylboroniques, notamment des acides arylboroniques non substitués, monosubstitués, disubstitués, trisubstitués, tétrasubstitués et pentasubstitués.
Acides hétéroarylboroniques
Les acides hétéroarylboroniques sont un interméacuteacute ;diaire de synthèse couramment employéacute ; dans la réaction de couplage croisé ; de Suzuki-Miyaura catalysée par le palladium, ainsi que dans d'autres réactions. Ces éléments de base, ou building blocks, sont hétérocycliques et aromatiques. Ils sont aussi utilisés dans le couplage de Chan-Lam, les homologations, les additions conjuguées, les réarrangements allyliques électrophiles, le couplage de Lieberskind-Strogl, le couplage de Sonogashira et le couplage de Stille.
Esters de boronate
Une caractéacuteacuteacute ;ristique importante des acides boroniques est leur capacité ; à ; former de manière réversible des esters avec les diols en solution aqueuse. Les esters de boronate sont stables à ; l'air et en chromatographie, et sont compatibles avec les études spectroscopiques. Le couplage croisé ; de Suzuki-Miyaura fonctionne avec les esters de boronate. Un problème sous-jacent, cependant, concerne les incompatibilités au niveau du schéma réactionnel entre la plupart des réactifs de synthèse. Les équivalents du type ester boronique sont souvent employés pour contrer cette incompatibilité ; et sont plus compatibles avec bon nombre de schémas de synth&.egrave;se, même si la libération de l'acide boronique nécessite des conditions extrêmes qui interfèrent avec les substrats de synthèse.
Les esters de boronate protégés par l'acide N-méthyliminodiacétique ;(MIDA) sont une nouvelle classe de réactifs particulièrement prometteuse pour les réactions de couplage croisé ; de Suzuki-Miyaura itératives. Comparativement aux réactifs utilisés jusqu'à-là ;, les esters MIDA sont faciles à ; manipuler, ne réagissent pas dans les conditions de couplage croisé ; anhydres, ont une stabilit&.eacute ; infinie lorsqu'ils sont laissés à ; l'air libre sur la paillasse, et peuvent être aisément déprotégés en conditions aqueuses basiques douces. Le succès de cette nouvelle classe de réactifs est liée à ; l'architecture moléculaire unique de ces composés. Comparés aux moléacute;cules à ; liaison B–N plus simples que sont le borazane et le triméacute ;thylamine borane, les esters MIDA sont bien plus volumineux, et l'atome de bore dans l'état d'hybridation sp3 est sécurisé ; par deux cycles à ; cinq chaînons, ce qui accroî ;t considérablement la stabilité ; de l'acide boronique et permet la synthèse de molécules complexes.
Les esters d'α-aminoboronate chiraux, composés au vaste champ d'application en pharmacologie, peuvent être synthétisés par addition nucléophile (sans méacute;tal) de boryle sur des tosylaldimines. Les esters de boronate sont employés dans les dispositifs électroniques organiques.
Réactifs de borylation
La réaction de Miyaura est un puissant outil de synth&ea ?egrave;se de boronates par couplage croisé ; de réactifs de borylation avec des halogénures d'aryle et de vinyle. Les produits borylés peuvent être purifiés facilement par des techniques chromatographiques et sont stables à ; l'air. Une forte activation du produit peut initier le couplage de Suzuki concurrent. Le choix d'une base appropriée est donc crucial pour le succès de la réaction de borylation.
On utilise la plupart du temps des réactifs à ; base de lithium ou des réactifs de Grignard en association avec une source de bore électrophile pour créer les liaisons C–B. Toutefois, du fait de la nature fortement nucléacute;ophile et basique des espève;ces métalliques impliquées dans ce procédure en deux étapes, divers groupements fonctionnels ne sont pas bien toléacute;rés. Les conditions réacuteacute;actionnelles douces de la réacute;action de borylation permettent de préacute;parer des boronates qui ne sont pas accessibles via les intermédiaires du type lithium ou Grignard.
Boronates MIDA
Les boronates MIDA sont une classe d&apos ;acides boroniques bloqués qui s'avère exceptionnellement performante dans les couplages croisés de Suzuki-Miyaura itératifs. Ces substituts d'acide boronique atténuent la transméacute;tallation entre l'acide boronique et les espève;ces à ; base de palladium. Toutefois, leur déprotection se fait facilement à ; tempéacute;rature ambiante en conditions aqueuses basiques douces à ; l'aide de NaOH 1 M, voire de NaHCO3. De plus, les boronates MIDA sont remarquablement robustes en cas de traitement par divers réactifs forts courants (réactif de Jones par exemple) afin de transformer le dérivéacute ; tout en maintenant la partie MIDA intacte.
Sels de trifluoroborate
Les sels de trifluoroborate de potassium (R-BF3K) sont une classe polyvalente de réactifs qui constitue une alternative efficace aux réactifs du type organoborane largement employés. Non seulement les sels de trifluoroborate sont trèveve;s stables et peuvent être stockés pendant de longues périodes, mais en plus leur stœchiomé ;trie est facile à ; caractériser, puisqu'ils ne se transforment pas facilement en trimères, contrairement à ; leurs équivalents du type acide boronique. Les sels de trifluoroborate sont largement employés dans la formation de liaisons C–C (couplages croisés de Suzuki-Miyaura notamment) et sont également stables en conditions oxydantes et en cas d&.apos;échange métal-halogène, ce qui en fait des "acides boroniques protéacute;gés" ; dans certains milieux réactionnels.
Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?