생물학적 SPME를 이용한 시료 청정도 분석
시료 전처리는 분석을 위한 시료 준비 및 매트릭스 효과를 제거하기 위해 수행된다. 매트릭스 효과는 분석 대상 물질의 신호를 방해할 수 있는 내인성 물질에 의해 발생한다.¹ 매트릭스 효과에 민감한 분석법 중 하나는 LC-MS/MS이다. 혈장은 단백질, 지질, 염류 및 탄수화물을 포함하는 복잡한 매트릭스로, 일정한 시료 전처리가 필요하다. 이러한 문제점을 해결하지 못하면 잠재적인 매트릭스 효과뿐만 아니라 분석 시간 증가, 새 컬럼 투자, 또는 기기 유지보수 시간 증가로 이어질 수 있습니다. 본 연구에서는 LC-MS/MS 분석을 위한 시료 전처리에서 고체상 미세 추출법(SPME)과 Supel™ BioSPME C18 96-핀 도구의 효과성을 보고합니다. 이전 연구에서는 단백질 결합 값 측정용 시료 전처리에서 BioSPME의 능력을 입증한 바 있습니다.2
인산지질 제거 효율: BioSPME 대 아세토니트릴 단백질 침전법
BioSPME 96핀 툴(그림 1)을 이용한 추출 후 시료에 잔류하는 인지질 양을 아세토니트릴 보조 단백질 침전 후 잔류 인지질 양과 비교하였다. BioSPME 절차는 그림 2에 개략적으로 설명되어 있다. 간단히 말해, 핀 도구는 이소프로판올에서 컨디셔닝한 후 물로 간단히 헹군다. 이 시점에서 핀 도구는 추출 준비가 완료된다. 추출 후, 핀 도구는 분석 대상 물질이 탈착되기 전에 핀 표면에 남아 있을 수 있는 단백질을 제거하기 위해 간단히 헹군다. 이후 분석 준비가 완료된다.
단백질 침전은 100µL의 인간 혈장과 300µL의 아세토니트릴을 혼합하여 수행하였다. 혼합물은 4°C에서 20분간 보관한 후 5,000rpm으로 10분간 원심분리하였다. 상층액을 옮겨 10psi 질소 기류 하에서 45°C에서 건조시켰습니다. 이후 시료를 초기 이동상 200µL에 재현탁시켰습니다.
두 가지 방법으로 채취한 다섯 개의 시료를 AB Sciex-3200 Q Trap 질량 분석기와 Agilent 1290 LC를 사용하여 표 1에 기술된 방법으로 분석하였다. 모니터링한 인지질은 표 2에 기재되어 있다.
혈장으로부터 알부민 단백질 제거
핀에 비특이적으로 잔류한 단백질의 양은 NanoOrange™ 키트를 사용하여 측정하였다. 핀(8개)은 정적 조건 하에서 웰 플레이트에 800 µL의 이소프로판올 용액에 20분간 처리하였다. 이후 핀을 800 µL의 물로 10초간 세척하였다. 풀링된 인간 혈장(800 µL) 추출은 96-웰 플레이트에서 1200 rpm, 3 mm 궤도 반경으로 교반하며, 써모 어댑터를 37 °C로 설정하여 수행했다. 추출 후 핀들은 물로 1분간 세척했다.
제품 설명서에 명시된 대로 작업용 용액(단백질 염색용 염료) 1mL를 웰 플레이트의 해당 웰에 주입하여 다른 웰 플레이트를 준비했습니다. 소 혈청 알부민(BSA) 추출에 사용된 핀을 작업용 용액에 노출시킨 후 300rpm으로 교반하면서 90-96°C에서 10분간 반응시켰습니다. 웰 플레이트는 시료를 빛으로부터 보호하기 위해 호일로 덮었습니다. 그런 다음 시료를 실온으로 냉각시켰습니다.
샘플은 Thermo Scientific Dionex HPLC 기기에서 형광 검출기를 사용한 직접 유동(컬럼 없음) 방식으로 분석되었으며, 자세한 내용은 표 3을 참조하십시오. 샘플은 0.1–5.0 µg/mL 범위의 BSA에 대한 외부 교정을 사용하여 피크 높이로 정량화되었습니다.
LC-MS/MS를 이용한 전체 시료 청정도 측정
시료의 청정도 측정은 다음 세 가지 조건에 대해 총 이온 크로마토그램(TIC)을 측정하여 결정하였다: 80:20 탈착 용액(메탄올:물, 부피비) 대조군, BioSPME로 추출한 첨가 혈장 시료, 아세토니트릴 보조 단백질 침전 혈청 시료.
아세토니트릴 보조 단백질 침전 시료는 다음과 같이 준비하였다. 추출 시료에 사용된 혈장과 동일한 양의 첨가 혈장 시료를 아세토니트릴(v/v)로 3배 희석하였다. 이 시료를 4°C에서 10,000 rpm으로 10분간 원심분리하였다. 이 후 상층액을 제거하고 질소 하에서 10psi로 건조시킨 후, 용매 효과를 최소화하고 시료 청정도를 더 잘 반영하기 위해 탈착 용액에 재현탁시켰다. 세 가지 시료 모두 표 1에 기술된 대로 2µL 주입량과 100~900 m/z 범위의 Q1 스캔을 사용하여 분석하였다 . 관심 시료마다 메탄올을 여러 번 주입하여 시료 간 잔류물 이송을 제거하였다.
결과 및 논의: Supel™ BioSPME 96-PIN 장치가 아세토니트릴 기반 시료 전처리보다 우수한 성능을 보임
BioSPME로 준비된 시료의 인지질 함량을 아세토니트릴 보조 단백질 침전법으로 준비된 시료와 비교하였다. 표 4에서 볼 수 있듯이, BioSPME를 사용한 최종 추출 시료에는 아세토니트릴 보조 단백질 침전 대조군에 비해 0.1% 미만의 인지질이 잔류하였다. 두 조건을 비교한 시료 크로마토그램은 그림 3에 제시되어 있다.

그림 3.대조군 시료(아세토니트릴 단백질 침전, 보라색)와 BioSPME 시료(녹색)의 인지질에 대한 대표 크로마토그램(2 µL 주입).
나노오렌지™(NanoOrange™) 연구에 따르면, 핀 도구는 핀 표면에 약 1.2 µg의 단백질(BSA 대비 정량)을 축적했습니다. 교정용 핀과 비교한 핀의 대표 크로마토그램은 그림 4에서 확인할 수 있습니다. 알부민은 혈장 내 총 단백질의 절반 이상(35mg/mL~50mg/mL)을 차지합니다.³ 이 값은 테스트된 8개의 핀에 걸쳐 표 5에 표시된 바와 같이 최종 추출 샘플 내 단백질의 0.01% 미만에 해당합니다.
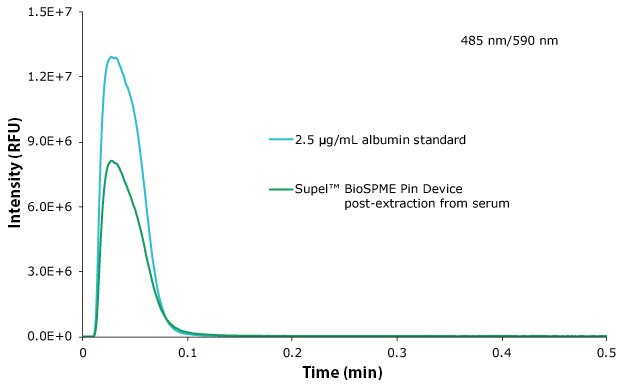
그림 4.알부민 단백질, 추출 핀(파란색), 및 2.5 µg/mL 표준(검정색)의 대표 크로마토그램.
표준 시료 대비 더 깨끗한 시료를 입증하기 위해, 단백질 침전 혈장 시료, BioSPME 추출 혈장 시료 및 탈착 용액에 대해 전체 TIC를 수집하였다( 그림 5 참조 ). 보여지듯이, BioSPME 추출 시료는 아세토니트릴 침전 시료보다 탈착 용액에 훨씬 더 가깝습니다. 탈착 용액에서 관찰되는 피크는 존재하는 중수소 표지 카르바마제핀(RT ~4.5분)에 해당합니다.
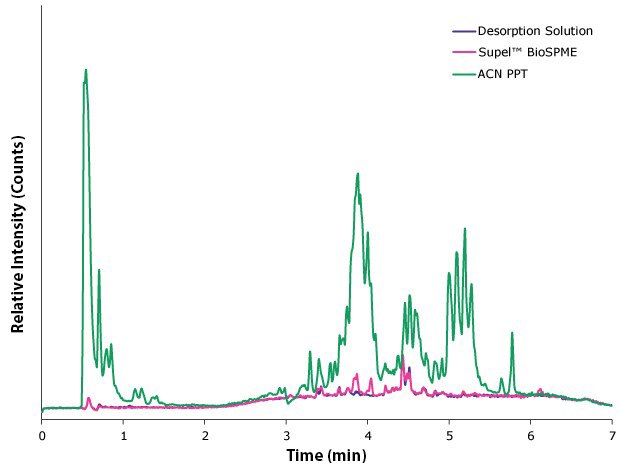
그림 5.단백질 침전 시료(녹색), BioSPME 추출 시료(분홍색), 탈착 용액(파란색) 내 인지질의 TIC 크로마토그램(5 µL 주입). 크로마토그램은 동일한 상대 카운트로 조정되었습니다.
결론: BioSPME를 통한 효과적인 시료 전처리
이 BioSPME 96핀 도구는 인간 혈장 분석을 위해 최소한의 매트릭스 효과를 가진 깨끗한 시료를 신속하고 효율적으로 전달하는 방법을 제공합니다.
재료
참고문헌
계속 읽으시려면 로그인하거나 계정을 생성하세요.
계정이 없으십니까?