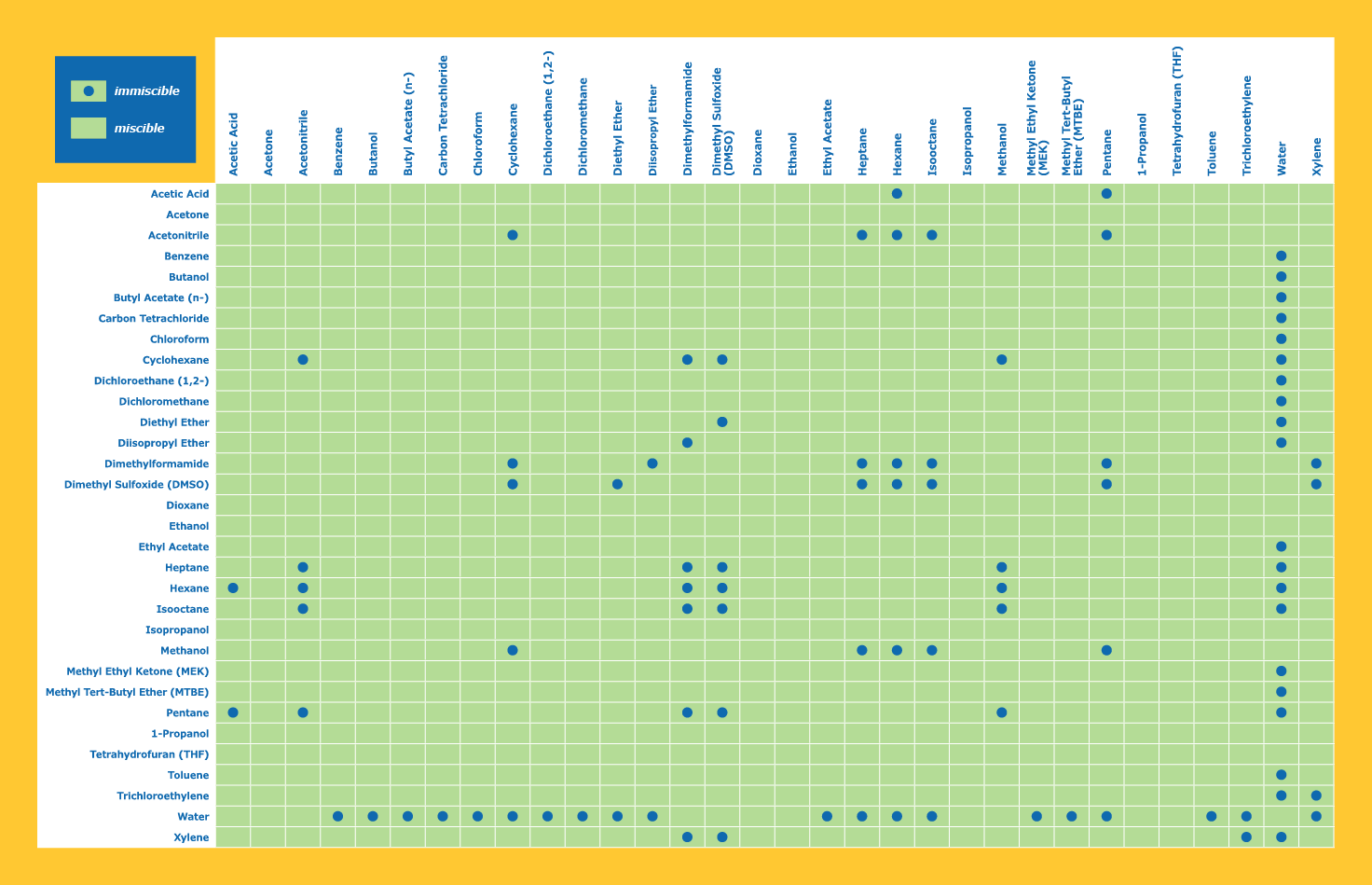
Tableau de miscibilité des solvants

Qu'est-ce que la miscibilité ?
La miscibilité définit la façon dont les substances se combinent (ou se mélangent) pour former une solution homogène sans précipités. La miscibilité se réfère le plus souvent aux liquides, mais peut également s'appliquer aux phases gazeuses et solides.
La recherche sur la miscibilité concerne souvent le science des matériaux domaine de la chimie où des stratégies supplémentaires pour prédire les interactions entre les substances pourraient accélérer les découvertes. Des applications spécifiques ont été signalées dans plusieurs domaines :
- Recherche sur les polymères pour les produits pharmaceutiques
- Nouveaux solvants pour les matériaux avancés tels que les semi-conducteurs organiques
- liquides ioniques utilisés comme électrolytes, comme dans le cas des batteries lithium-ion rechargeables
Produits apparentés
Comment déterminer la miscibilité
La détermination la plus courante de la miscibilité est l'évaluation visuelle. Si deux substances forment une couche, il est clair qu'elles ne sont pas miscibles. Les méthodes de détermination plus précises comprennent l'analyse chromatographique telle que la spectroscopie, ainsi que la viscosimétrie, l'osmétrie et la calorimétrie.
Il est assez facile de rechercher la miscibilité des solvants de laboratoire courants sur des tableaux tels que celui fourni ci-dessous ; cependant, il est peu probable que des substances ou des combinaisons de solvants nouvelles et inédites soient répertoriées. Dans ces cas, la miscibilité peut être prédite en utilisant les mêmes règles générales pour la solubilité. Ce qui est semblable se dissout comme ce qui est semblable. Les composés présentant des types de liaisons similaires sont plus susceptibles d'être solubles (et parfois miscibles).<<./a>
Comment la miscibilité d'un liquide avec l'eau est-elle liée à la polarité du liquide ?
La polarité a un effet direct sur la solubilité (et la miscibilité). Les liquides ont tendance à être miscibles avec des liquides de polarité similaire, et il en va de même pour les substances non polaires. En effet, les forces d'attraction ou de répulsion entre les molécules du mélange seront approximativement égales, même si d'autres types de molécules ont été ajoutés. Un liquide dont la polarité est similaire à celle de l'eau devrait donc être miscible dans l'eau.
Mesurer la polarité
Le moment dipolaire d'une liaison est la mesure de la polarité d'une liaison chimique. Il est mesuré de 0 à 11 débytes (D), 0 indiquant un moment dipolaire nul et 11 un moment fortement polaire. Pour de nombreuses substances, telles que les liquides liés par covalence, il est utile de connaître la polarité d'une molécule entière plutôt que de ses liaisons individuelles. Les chimistes estiment que la somme vectorielle des moments dipolaires des liaisons d'une molécule est une estimation de la polarité de la molécule. Les mesures du moment dipolaire de liaison peuvent être trouvées sur les pages des solvants individuels dans notre centre de solvants.
Tableau de miscibilité des solvants
Tableau de miscibilité Téléchargements
Notre tableau de miscibilité des solvants peut être téléchargé gratuitement. Partagez-le avec vos amis, vos étudiants ou vos enseignants. N'oubliez pas de faire un lien vers cette page.
Vous avez des commentaires sur nos outils d'étude et de laboratoire ? Utilisez les liens ci-dessus pour nous contacter ou laissez un commentaire sur l'un de nos comptes de médias sociaux.
Solubilité et miscibilité
La solubilité et la miscibilité décrivent des phénomènes similaires, mais ne sont pas identiques.
La solubilité existe sur un spectre. Les substances peuvent se combiner mal ou très bien, et il est possible de décrire les solutions comme étant "partiellement solubles" ; ou "principalement solubles"
La miscibilité, en revanche, est une propriété absolue qui ne s'exprime pas en degrés. Lorsque des substances sont miscibles, il n'y a pas d'effets de couches, de précipités, de mélanges partiels ou de séparation. Si deux substances sont miscibles, elles sont également complètement solubles l'une dans l'autre, quel que soit l'ordre d'introduction. Par exemple, le tétrahydrofurane (THF) et l'eau sont miscibles.
Miscibility Gap
Un écart de miscibilité se produit lorsque les substances mélangées existent dans plus d'une phase et qu'il en résulte un écart de miscibilité. En d'autres termes, les substances ne peuvent pas se mélanger parce qu'elles n'existent pas dans la même phase ou dans la phase compatible dans les conditions données. La phase est affectée par la température et la pression.
Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?