オリゴのアニーリングプロトコル

アニーリングについて
オリゴのアニーリングは、相補的一本鎖オリゴヌクレオチドから二本鎖DNAの形成を促進するため、分子生物学において非常に重要なステップです。このプロセスは、DNA鎖の正しい塩基対形成が必要とされるPCR、遺伝子クローニング、配列決定などのダウンストリームアプリケーションを正確に実施するために不可欠です。正しくアニーリングしないと、ミスマッチは不完全なハイブリダイゼーションが発生して、効率の低下、増幅エラーの発生、または不正確な遺伝子合成が引き起こされます。さらに、オリゴアニーリングにより、DNA断片が安定で、ライゲーションや複製などの酵素反応の準備ができていることが保証されるため、遺伝子研究やバイオテクノロジーの基礎をなす技術となっています。
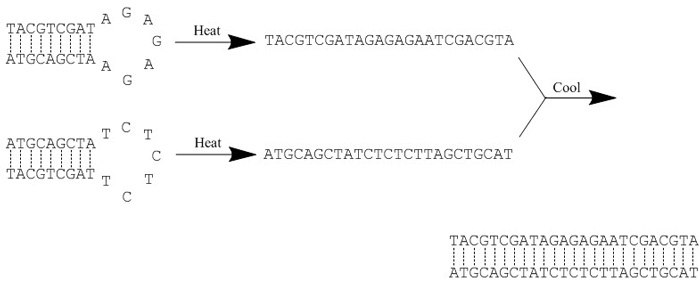
図1.アニーリング反応の例。加熱によってすべての水素結合が「切断」され、各オリゴヌクレオチド内の二次構造が破壊される。続いて緩やかな冷却によって、相補的配列間に新たな水素結合が形成され、ハイブリダイゼーションが促進される。
定義と略語
- EDTA: エチレンジアミン四酢酸
- NaC: 塩化ナトリウム
- Trizma® base: Tris[トリス(ヒドロキシメチル)アミノメタン]のブランド名
- オリゴ: オリゴヌクレオチドまたはオリゴマーの略語。オリゴヌクレオチドは、短い一本鎖DNAまたはRNA分子であり、相補的DNAまたはRNA鎖と結合して二本鎖を形成するには、アニール(加熱または融解)する必要があります。
- DNAアニーリング: このページでは、すべてのオリゴヌクレオチドのアニーリング工程を紹介します。アニーリングは、RNAにも同様に使用される工程でもありますが、DNAアニーリングと呼ばれることがあります。アニーリングとは、相補的配列を有する2つの一本鎖オリゴヌクレオチドを加熱・冷却して二本鎖を形成させる工程です。加熱によってすべての水素結合が切断され、冷却によって配列間に新しい結合が形成されます。
DNA/RNAアニーリングの装置と消耗品
- ヒートブロックまたはサーマルサイクラー
- 2mL遠心チューブ
- ピペットチップ
- Milli-Q® H2O
- EDTA(製品番号 E9884)
- NaCl(製品番号 S3014)
- Trizma® base(製品番号 93362)
- 相補的配列を有する2つの一本鎖オリゴヌクレオチド
DNA/RNAアニーリング法
アニーリング工程は、ヒートブロックまたはサーマルサイクラーのいずれかによる1)溶解、2)アニーリングの2つの主要ステップに分けられます。
オリゴの溶解
各オリゴヌクレオチドは、あらかじめ分量が測定された状態で納品されますが、最良の結果を得るために、反応ごとに各オリゴヌクレオチドを確実に等量ずつ加えられるよう、分光光度計で量を確認してください。
- 各オリゴヌクレオチドを所定量のアニーリングバッファー(バッファーの組成は下記参照)に溶解し、それぞれ同じ濃度になるようにします。
- 各オリゴヌクレオチドの濃度は、目的とする二本鎖オリゴヌクレオチドの濃度の2倍である必要があります。
例
目的とする二本鎖オリゴヌクレオチドの濃度は50 µMです。
- オリゴヌクレオチド1:10.55 OD(312.6 µg、49.9 nmol)で供給;分光光度計によりOD測定値を確認します。
- オリゴヌクレオチド2:9.04 OD(279.7 µg、45.9 nmol)で供給;分光光度計によりOD測定値を確認します。
- 各オリゴヌクレオチドのストック溶液の濃度は、目的とする二本鎖オリゴヌクレオチドの濃度の2倍である必要があります。つまり、各ストック溶液は100 µMでなければなりません。
- オリゴヌクレオチド1には、49.9×10=499 µLのアニーリングバッファーを加えて100 µMのストック溶液を調製します。
- オリゴヌクレオチド2には、45.9×10=459 µLのアニーリングバッファーを加えて100 µMのストック溶液を調製します。
*この計算は簡略化しており、100 µMの溶液を調製する場合にのみ使用できます。ここでは具体例として使用しています。さまざまなオリゴヌクレオチド濃度の計算に関する詳細は、「オリゴヌクレオチドの取扱い」をご参照ください。
オリゴのアニーリング
ヒートブロック
- 等モル濃度のオリゴヌクレオチドを等量ずつマイクロチューブに加えて撹拌します。
- マイクロチューブを95℃で5分間インキュベートします。
- マイクロチューブをゆっくりと室温まで冷却させます(60分未満)。
サーマルサイクラー
ヒートブロックでもアニーリングは可能ですが、サーマルサイクラーではより工程の一貫性が保てます。
- 等モル濃度のオリゴヌクレオチドを等量ずつPCRチューブに加えて撹拌します。
- 以下の温度プロファイルを使用します。
- 95℃まで加熱後、2分間保温
- 45分間かけて25℃まで冷却
- 一時的に4℃まで冷却
- 95℃まで加熱後、2分間保温
- PCRチューブを短時間遠心分離機にかけ、蓋に残らないようにします。
ヒートブロックまたはサーマルサイクラーの使用後、二本鎖オリゴヌクレオチドは使用または保管が可能な状態になっています。オリゴヌクレオチドの保管に関する詳細は、 「オリゴヌクレオチドの取扱い」をご参照ください。
DNAアニーリング用バッファーの組成と成分の説明
バッファーはすべてMilli-Q® 水で調製してください。
アニーリングバッファーの組成(1倍)
DNAアニーリングの場合、オリゴヌクレオチドが最適にハイブリダイズできるように、バッファーには通常、塩類と安定化剤が含まれています。一般的な組成:
- 10 mM Tris-HCl(pH 7.5-8.0) – 反応のために安定なpHを保ちます。
- 50 mM NaCl – ハイブリダイゼーションを促進するために必要なイオン強度を付与します。
- 1 mM EDTA – ヌクレアーゼによる分解を防ぐために二価カチオンをキレートします。
オリゴをアニーリングするには、オリゴをこのバッファーと混合し、2~5分間95°Cで加熱した後、ゆっくりと室温まで冷却して、オリゴがハイブリダイズして安定な二本鎖DNAを形成できるようにします。バッファーはすべてMilli-Q® Type I水で調製してください。
リガーゼバッファーの組成(1倍)
標準的なリガーゼバッファーの組成には、一般的に以下の成分が含まれています:
- 50 mM Tris-HCl(pH 7.5-8.0) – ライゲーション反応のために安定なpH環境を作ります。
- 10 mM MgCl₂ – DNAリガーゼ活性の補助因子として必須です。
- 10 mM DTT(ジチオスレイトール):リガーゼ酵素の還元状態を維持するのに役立ちます。
- 1 mM ATP – ライゲーションプロセスのエネルギー源として必要です。.
- 25 µg/mL BSA(オプション) – 反応中に酵素を安定化させます。
このバッファーは、最適なライゲーション条件をサポートして、DNA断片が効率的につなげられるようにします。
キナーゼバッファーの組成(1倍)
一般的なキナーゼバッファーの組成には、以下の成分が含まれています:
- 50 mM Tris-HCl(pH 7.5) – キナーゼ活性のために最適なpHを保ちます。
- 10 mM MgCl₂ – キナーゼ機能に必要な補助因子です。
- 5 mM DTT(ジチオスレイトール):酵素の活性な還元状態を維持します。
- 1 mM ATP – リン酸化反応のためにリン酸基を提供します。
このバッファーは、基質の効率的なリン酸化を保証するもので、ポリヌクレオチドキナーゼ(PNK)が使用される反応においてDNAやRNAの末端にリン酸基を付加するために一般的に使用されます。
関連製品
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?