Protocole de test de viabilité et de prolifération cellulaires au MTT
Introduction
Le test au MTT permet de mesurer l'activité métabolique cellulaire, indicateur de la viabilité, de la prolifération et de la toxicité cellulaires. Ce dosage colorimétrique repose sur la réduction d'un sel de tétrazolium jaune [le bromure de 3-(4,5-diméthylthiazol-2-yl)-2,5-diphényltétrazolium ou MTT] en cristaux de formazan violets par les cellules métaboliquement actives (Figure 1)6,7,35. En effet, les cellules viables contiennent des oxydoréductases NAD(P)H-dépendantes qui réduisent le MTT en formazan36. Les cristaux de formazan insolubles sont dissous avec une solution de solubilisation et la solution colorée résultante est quantifiée par mesure de l'absorbance entre 500 et 600 nanomètres à l'aide d'un spectrophotomètre multipuits. Plus la solution est foncée, plus le nombre de cellules métaboliquement actives viables est important.
Ce système de dosage colorimétrique non radioactif au MTT a été décrit pour la première fois par T. Mosmann et al.1, avant d'être amélioré par plusieurs autres chercheurs dans les années suivantes2-6. Le kit de test de prolifération cellulaire I (test au MTT) est un kit optimisé qui contient des réactifs prêts à l'emploi ; il ne nécessite aucune étape de lavage et aucun réactif supplémentaire. Il s'agit d'un dosage quantitatif qui permet de manipuler simplement et rapidement un grand nombre d'échantillons. Le kit de test de prolifération cellulaire I (test au MTT) peut être utilisé pour une multitude d'applications, notamment :
- Quantification de la croissance et de la viabilité cellulaires1,3,5-7
- Mesure de la prolifération cellulaire en réponse à des facteurs de croissance, des cytokines et des nutriments1-3,6,8-12 (voir Figure 3)
- Mesure de la cytotoxicité, par exemple quantification des effets du facteur de nécrose tumorale alpha ou bêta13,14(voir Figure 2) ou de la mort cellulaire induite par les macrophages15,16 et évaluation d'agents cytotoxiques17-34 ou d'inhibiteurs de croissance tels que les anticorps bloquants
- Étude de l'activation cellulaire4
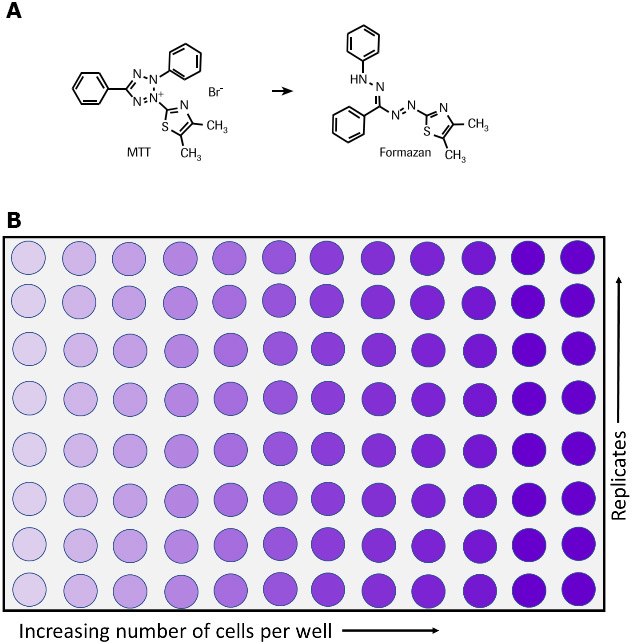
Figure 1.Métabolisme du MTT en formazan par les cellules viables, représenté sous forme de réaction chimique (A) et sur une plaque de 96 puits (B).
Composants du kit de test de prolifération cellulaire I (test au MTT) (réf. 11465007001)
Réactif au MTT
- Prêt à l'emploi, non stérile
- 5 fioles contenant 5 ml de MTT [bromure de 3-(4,5-diméthylthiazol-2-yl)-2,5-diphényltétrazolium] (concentré 1 ×) à 5 mg/ml dans un tampon phosphate salin (PBS, réf. 806552)
Solution de solubilisation
- Concentrée 1 ×, prête à l'emploi
- 3 flacons de 90 ml
Protocole de test pour la mesure de la cytotoxicité
Réactifs supplémentaires nécessaires :
- Milieu de culture, par exemple RPMI 1640 (réf. R0883) contenant 10 % de sérum de veau fœtal inactivé par chauffage (réf. 12106C), de la glutamine 2 mM (réf. G6392) et 1 μg/ml d'actinomycine C1 (actinomycine D, réf. A9415).
- En cas d'utilisation d'un antibiotique, supplémenter également le milieu en pénicilline/streptomycine ou en gentamicine.
- Facteur de nécrose tumorale α humain (hTNF-α) (10 μg/ml), stérile (réf. T6674).
Protocole :
Ce test permet de déterminer l'effet cytotoxique du facteur de nécrose tumorale α humain (hTNF-α, réf. T6674) sur les cellules WEHI-164 (lignée cellulaire de fibrosarcome de souris, réf. 87022501) (voir Figure 2).
- Préincuber les cellules WEHI-164 à une concentration de 1 × 106 cellules/ml dans le milieu de culture contenant 1 μg/ml d'actinomycine C1 pendant 3 heures à 37 °C sous 5 % à 6,5 % de CO2.
- Ensemencer les cellules à raison de 5 × 104 cellules/puits dans 100 μl de milieu de culture contenant 1 μg/ml d'actinomycine C1 et diverses quantités de hTNF-α (exemple de concentration finale : 0,001 à 0,5 ng/ml) sur des microplaques (qualité "culture tissulaire", 96 puits, à fond plat).
- Incuber les cultures de cellules pendant 24 heures à +37 °C sous 5 % à 6,5 % de CO2.
- Une fois le temps d'incubation écoulé, ajouter 10 μl de réactif de marquage au MTT (concentration finale : 0,5 mg/ml) dans chaque puits.
- Incuber la microplaque pendant 4 heures en atmosphère humide (p. ex. +37 °C, 5 % à 6,5 % de CO2).
- Ajouter 100 µl de solution de solubilisation dans chaque puits.
- Laisser la plaque reposer dans l'incubateur pendant une nuit en atmosphère humide (p. ex. +37 °C, 5 % à 6,5 % de CO2).
- Vérifier que les cristaux de formazan violets se sont entièrement solubilisés et mesurer l'absorbance des échantillons à l'aide d'un lecteur de microplaques (lecteur ELISA). La longueur d'onde de mesure de l'absorbance du formazan se situe entre 550 nm et 600 nm, selon les filtres disponibles pour le lecteur ELISA utilisé. La longueur d'onde de référence doit être supérieure à 650 nm.
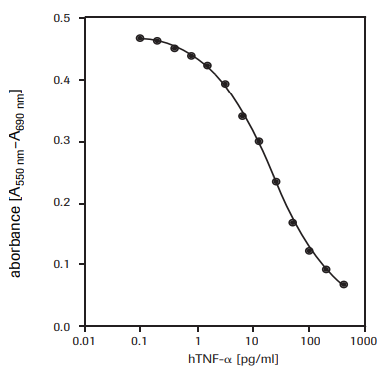
Figure 2.Détermination de l'activité cytotoxique du TNF-α humain (hTNF-α) recombinant sur les cellules WEHI-164 (lignée cellulaire de fibrosarcome de souris) avec le test au MTT.
Protocole de test pour la mesure de la croissance cellulaire
Réactifs supplémentaires nécessaires :
- Milieu de culture (p. ex. DMEM, réf. D5671) contenant 10 % de sérum de veau fœtal inactivé par chauffage (réf. 12106C)
- Glutamine 2 mM (réf. G6392)
- L-arginine 0,55 mM (réf. A8094)
- L-asparagine monohydratée 0,24 mM (réf. A4284)
- 2-mercaptoéthanol 50 μM (réf. M3148)
- Supplément HT pour milieux de culture (réf. H0137) (concentré 1 ×) contenant de l'hypoxanthine 0,1 mM et de la thymidine 16 μM (En cas d'utilisation d'un antibiotique, supplémenter également le milieu en pénicilline/streptomycine ou en gentamicine)
- Interleukine 6 humaine (hIL-6, réf. SRP3096) (200 000 U/ml, 2 μg/ml) stérile
Protocole
Ce test permet de déterminer l'activité de l'interleukine 6 humaine (hIL-6) sur les cellules 7TD1 (lignée cellulaire d'hybridome souris/souris, DSMZ, ACC 23) (voir Figure 3).
- Ensemencer les cellules 7TD1 à raison de 2 × 103 cellules/puits dans 100 μl de milieu de culture contenant diverses quantités d'IL-6 [exemple de concentration finale : 0,1 à 10 U/ml (0,001 à 0,1 ng/ml)] sur des microplaques (qualité "culture tissulaire", 96 puits, à fond plat).
- Incuber les cultures de cellules pendant 4 jours à +37 °C sous 5 % à 6,5 % de CO2.
- Une fois le temps d'incubation écoulé, ajouter 10 μl de réactif de marquage au MTT (concentration finale : 0,5 mg/ml) dans chaque puits.
- Incuber la microplaque pendant 4 heures en atmosphère humide (p. ex. +37 °C, 5 % à 6,5 % de CO2).
- Ajouter 100 μl de solution de solubilisation dans chaque puits.
- Laisser la plaque reposer dans l'incubateur pendant une nuit en atmosphère humide (p. ex. +37 °C, 5 % à 6,5 % de CO2).
- Vérifier que les cristaux de formazan violets se sont entièrement solubilisés et mesurer l'absorbance spectrophotométrique des échantillons à l'aide d'un lecteur de microplaques (lecteur ELISA). La longueur d'onde de mesure de l'absorbance du formazan se situe entre 550 nm et 600 nm, selon les filtres disponibles pour le lecteur ELISA utilisé. La longueur d'onde de référence doit être supérieure à 650 nm.
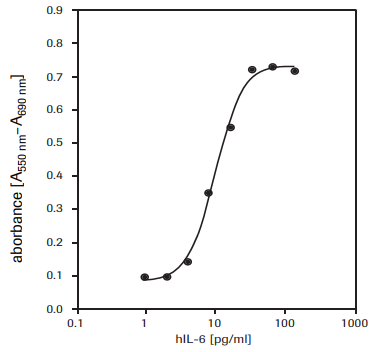
Figure 3.Détermination de la prolifération des cellules 7TD1 (lignée cellulaire d'hybridome souris/souris) en réponse à l'interleukine 6 humaine (hIL-6) recombinante avec le test au MTT.
Tests similaires
Le test au XTT et le test au WST-1 peuvent également être utilisés pour mesurer la viabilité et la prolifération cellulaires.
Produits
Références
Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?