Guide technique : test de prolifération et de viabilité cellulaires au WST-1
Protocoles, foire aux questions et guide de résolution des problèmes
Réf. produit : CELLPRO-RO
Introduction
La mesure de la prolifération et de la viabilité cellulaires est devenue une technique incontournable en sciences de la vie. Face à la nécessité de disposer de méthodes sensibles, fiables, rapides et faciles à mettre en œuvre, plusieurs tests de référence ont été mis au point. Il existe désormais des tests de prolifération qui permettent d'analyser le nombre de cellules viables par le clivage de sels de tétrazolium ajoutés au milieu de culture. Les sels de tétrazolium sont clivés en formazan par des enzymes cellulaires (Figure 1). Un accroissement du nombre de cellules viables se traduit par une augmentation générale de l'activité des déshydrogénases mitochondriales présentes dans l'échantillon, ce qui augmente à son tour la quantité de colorant formazan formée. Le formazan produit par les cellules métaboliquement actives peut être quantifié à l'aide d'un spectrophotomètre multipuits à balayage.
Le réactif de prolifération cellulaire WST-1 est conçu pour la quantification spectrophotométrique non radioactive de la prolifération, de la croissance, de la viabilité et de la chimiosensibilité de populations cellulaires sur des plaques au format 96 puits. Il peut être utilisé pour :
- mesurer la prolifération cellulaire en réponse à des facteurs de croissance, des cytokines ou des nutriments (Figure 2) ;
- évaluer des anticorps inhibiteurs de croissance et des médiateurs physiologiques ;
- analyser des composés cytotoxiques et cytostatiques, comme les médicaments anticancéreux et d'autres composés pharmaceutiques.
![Clivage du sel de tétrazolium WST-1 [4-[3-(4-iodophényl)-2-(4-nitro-phényl)-2H-5-tétrazolio]-1,3-benzènesulfonate] en formazan. (EC = réactif de couplage électronique ; RS = système succinate-tétrazolium réductase mitochondrial). Clivage du sel de tétrazolium](/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/protocols/cell-culture-and-analysis/cell-counting-and-health-analysis/formazen-dark-red/formazen-dark-red.png)
Figure 1.Clivage du sel de tétrazolium WST-1 [4-[3-(4-iodophényl)-2-(4-nitro-phényl)-2H-5-tétrazolio]-1,3-benzènesulfonate] en formazan. (EC = réactif de couplage électronique ; RS = système succinate-tétrazolium réductase mitochondrial).
Composants du kit (réf. CELLPRO-RO)
Le réactif de prolifération cellulaire WST-1 est une solution rougeâtre, limpide, prête à l'emploi, qui contient du WST-1 et un réactif de couplage électronique dilués dans un tampon phosphate salin, filtrée à travers une membrane à pores de 0,2 µm.
Témoin (blanc)
Déposer dans un puits les mêmes volumes de milieu de culture et de réactif de prolifération cellulaire WST-1 que ceux utilisés dans l'expérience (par exemple, 100 µl de milieu de culture cellulaire et 10 µl de WST-1). Utiliser ce témoin de bruit de fond comme position de mesure à blanc du lecteur ELISA. L'absorbance du bruit de fond dépend du milieu de culture, de sa durée d'incubation et de son exposition à la lumière. Au bout de 2 heures, elle est de 0,1 à 0,2 unité d'absorbance en moyenne.
Protocole de test pour la mesure de la croissance cellulaire
Ce test permet de déterminer l'activité de l'interleukine-2 humaine (hIL-2) sur la lignée de lymphocytes T de souris CTLL-2 (93042610) (Figure 2).
Autres réactifs nécessaires :
- Milieu de culture, par exemple RPMI 1640 (réf. R0883) contenant 10 % de sérum de veau fœtal inactivé par chauffage (FCS, réf. 12106C) et de la glutamine 2 mM (réf. G6392).
- Interleukine-2 humaine (hIL-2, réf. SRP3085) stérile.
- En cas d'utilisation d'un antibiotique, supplémenter également le milieu en pénicilline/streptomycine ou en gentamicine.
Protocole :
- Ensemencer les cellules CTLL-2 à raison de 4 × 103 cellules/puits dans 100 μl de milieu de culture contenant différentes quantités d'IL-2 (exemple de concentration finale : 0,005 à 25 ng/ml) sur des microplaques (qualité "culture tissulaire", 96 puits, à fond plat).
- Incuber les cellules pendant 48 heures à 37 °C sous 5 % de CO2.
- Ajouter 10 µl/puits de réactif de prolifération cellulaire WST-1 et incuber pendant 4 heures à 37 °C sous 5 % de CO2.
- Agiter pendant 1 minute sur un agitateur.
- À l'aide d'un lecteur de microplaques (lecteur ELISA), mesurer l'absorbance des échantillons par rapport à un témoin de bruit de fond (blanc). La longueur d'onde de mesure de l'absorbance du formazan produit se situe entre 420 nm et 480 nm (avec un pic d'absorbance à environ 440 nm), selon les filtres disponibles pour le lecteur ELISA. La longueur d'onde de référence doit être supérieure à 600 nm.
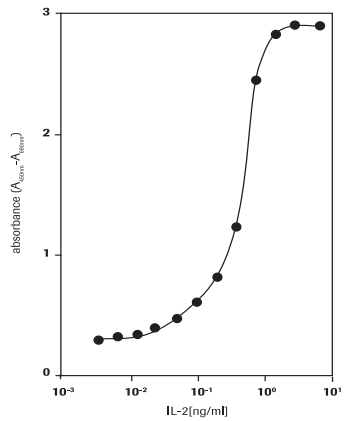
Figure 2.Mesure de la prolifération des cellules CTLL-2 en réponse à l'IL-2 humaine avec le test au WST-1.
Protocole de test pour la mesure de la cytotoxicité
Ce test permet de déterminer les effets cytotoxiques du facteur de nécrose tumorale α humain (hTNF-α, réf. T6674) sur les cellules WEHI-164 (lignée cellulaire de fibrosarcome de souris, réf. 87022501) (Figure 3).
Autres réactifs nécessaires :
- Milieu de culture, par exemple RPMI 1640 (réf. R0883) contenant 10 % de sérum de veau fœtal inactivé par chauffage (réf. 12106C), de la glutamine 2 mM (réf. G6392) et 1 μg/ml d'actinomycine C1 (actinomycine D, réf. A9415).
- Facteur de nécrose tumorale α humain (hTNF-α, réf. T6674) (10 μg/ml), stérile.
- En cas d'utilisation d'un antibiotique, supplémenter également le milieu en pénicilline/streptomycine ou en gentamicine.
Protocole :
- Cultiver les cellules sur des microplaques (qualité "culture tissulaire", 96 puits, à fond plat) dans un volume final de milieu de culture de 100 µl/puits en atmosphère humidifiée (37 °C, 5 % de CO2).
- Ensemencer les cellules à raison de 5 × 104 cellules/puits dans 100 μl de milieu de culture contenant 1 μg/ml d'actinomycine C1 et diverses quantités de hTNF-α (exemple de concentration finale : 0,001 à 0,5 ng/ml) sur des microplaques (qualité "culture tissulaire", 96 puits, à fond plat).
- Incuber les cultures de cellules pendant 24 heures à +37 °C sous 5 % de CO2.
- Ajouter 10 μl de réactif de prolifération cellulaire WST-1 et incuber pendant 4 heures à 37 °C sous 5 % de CO2.
- Agiter pendant 1 minute sur un agitateur.
- À l'aide d'un lecteur de microplaques (lecteur ELISA), mesurer l'absorbance des échantillons par rapport à un témoin de bruit de fond (blanc). La longueur d'onde de mesure de l'absorbance du formazan se situe entre 420 nm et 480 nm, selon les filtres disponibles pour le lecteur ELISA (Figure 3). La longueur d'onde de référence doit être supérieure à 600 nm.
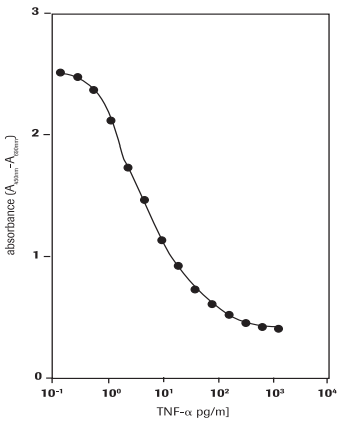
Figure 3.Détermination de l'activité cytotoxique du facteur de nécrose tumorale α humain (hTNF-α) sur les cellules WEHI-164 (lignée cellulaire de fibrosarcome de souris) avec le test au WST-1.
Foire aux questions et résolution des problèmes
1. Puis-je utiliser le kit CELLPRO-RO sur levures ou sur bactéries ?
Nous ne disposons d'aucune donnée sur l'utilisation de ces kits pour la mesure de la prolifération bactérienne ou levurienne ; ils n'ont pas non plus été conçus dans ce but. La façon la plus simple de mesurer la prolifération bactérienne ou levurienne consiste à déterminer la densité optique.
2. Faut-il attendre que les cellules se déposent au fond des puits pour effectuer la mesure ?
Il n'est pas nécessaire d'attendre que les cellules se déposent au fond des puits, car leur présence ne perturbe pas la mesure. Les cellules n'absorbent pas la lumière à la longueur d'onde utilisée pour la quantification du clivage du WST-1. Il est donc possible de procéder à la mesure juste après avoir agité les cellules, sans étape intermédiaire, conformément au protocole indiqué sur la notice.
3. Puis-je utiliser simultanément le réactif de prolifération cellulaire WST-1 et la BrdU du test colorimétrique de prolifération cellulaire ?
Dans la 4e édition de l'ouvrage "Apoptosis, Cytotoxicity and Cell Proliferation Manual" de Roche, la figure 52a montre l'utilisation conjointe du réactif de prolifération cellulaire WST-1 et de la bromodésoxyuridine (BrdU) du test ELISA (colorimétrique) de prolifération cellulaire pour mesurer simultanément la viabilité et la prolifération cellulaires. Un protocole est décrit dans la légende de la figure. Pour effectuer ces tests simultanément, vous devez commander les deux kits ; les aures produits nécessaires sont indiqués sur les notices.
4. Puis-je utiliser simultanément le réactif de prolifération cellulaire WST-1, le kit de test de prolifération cellulaire I (test au MTT) et le kit de test de prolifération cellulaire II (test au XTT) ?
Les tests au MTT, au XTT et au WST-1 utilisent des sels de tétrazolium différents pour mesurer l'activité métabolique des cellules actives. Chaque kit utilise une longueur d'onde différente pour détecter cette activité métabolique : 550 nm pour le test au MTT, 492 nm pour le test au XTT, et 420 nm à 480 nm pour le test au WST-1. Il pourrait être difficile de discriminer le signal de chaque sel. De plus, l'utilisation conjointe des sels MTT, XTT et WST-1 pourrait compromettre la sensibilité et la plage de détection linéaire de kits aux performances reconnues en cas d'utilisation séparée. Il est donc déconseillé d'utiliser le MTT, le XTT et le WST-1 simultanément.
5. Comment arrêter la réaction du WST-1 ?
La réaction du réactif de prolifération cellulaire WST-1 peut être arrêtée en plaçant l'échantillon au congélateur ou en ajoutant une solution de Triton X-100 à 1 % concenant 0,1 % de SDS (concentration finale) pendant 5 minutes à température ambiante (+15 °C à +25 °C ou +37 °C).
Résolution des problèmes
Interférences éventuelles du rouge de phénol et/ou du sérum de veau fœtal
Le rouge de phénol augmente l'absorbance de pas plus de 0,1 unité de densité optique ; les témoins négatifs permettent toutefois de compenser cette augmentation. De même, l'ajout de jusqu'à 10 % de sérum de veau fœtal ne pose aucun problème. Roche ne teste pas ce kit de manière systématique pour déterminer sa plage de tolérance au rouge de phénol ou au sérum de veau fœtal. De plus grandes quantités de sérum de veau fœtal ne devraient pas non plus poser de problème. En règle générale, le témoin négatif doit toujours être traité de la même manière que les échantillons.
Tests similaires
Le test au MTT et le test au XTT peuvent également être utilisés pour mesurer la viabilité et la prolifération cellulaires.
Produits
Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?