オリゴヌクレオチド精製

オリゴ精製の重要性
オリゴヌクレオチド精製は、合成したオリゴヌクレオチド(DNAやRNAの短い配列)を不完全な配列、塩類、有機副産物などの不純物から分離するプロセスです。これらの不純物は、オリゴヌクレオチドの化学合成中に生成され、最終製品の品質に影響を及ぼします。最適なオリゴ精製法は、オリゴの種類やアプリケーションに応じて選択します。最適な精製は、以下のような重要な性能上の利点をもたらします。
精度の向上
不純物は、PCR、配列決定、遺伝子編集などの下流のアプリケーションを妨げます。精製したオリゴでは、標的配列の結合においてより高い特異性と精度が確保されます1。
性能の向上
高純度オリゴヌクレオチドは、qPCRやハイブリダイゼーションなどの分子診断や研究アッセイにおいて結合効率を高めます2。
バックグラウンドノイズの低減
オリゴ製造副産物から夾雑物を除去することで、分子実験におけるバックグラウンドシグナルを最小限に抑えて、より正確な結果が得られます3。
実験の一貫性
オリゴ精製により、複数のテストにわたり信頼できる一貫した結果を得るために極めて重要である研究の再現性が確保されます4。
一般的な精製法には、脱塩、カートリッジ、HPLC(高速液体クロマトグラフィー)、PAGE(ポリアクリルアミドゲル電気泳動)精製などがあります。
オリゴ不純物の由来と精製オプション
DNAの製造中、各ヌクレオチドを順に結合させ、ホスホロアミダイト化学反応によりDNA鎖を伸長します。各結合サイクルで、オリゴヌクレオチド鎖の割合が低いと伸長せず、完全長配列(n)と不完全な配列(ショートマー)(n-1、n-2など)ができます。また、低分子不純物は切断プロセスや脱保護プロセスの副産物です。
切断、脱保護、および脱塩(低分子不純物を除去)後、さらに精製すると、目的外のショートマーから完全長配列を分離できます。
特定の技法/用途(表1)に必要な純度は、ショートマーの存在によって起こりうる問題によって異なります。
さらに、Biotin、Amino C2 dTなど、よくある修飾が付いたオリゴヌクレオチドは下記の方法で精製できます。ROX™、TxRd(Sulforhodamine 101-X)などの修飾により複雑な構造を取るオリゴヌクレオチドには、遊離色素を除去できるHPLCが適しています。
オリゴ精製法の説明
脱塩によるオリゴ精製
ホスホジエステル構造の脱保護で生じるアクリロニトリルなど、切断および脱保護の残留副産物である低分子不純物を脱塩によって除去します。PCRをはじめ多くの技法/用途で、脱塩は35塩基以下のオリゴヌクレオチドに推奨されます。これは完全長配列が圧倒的に多く、ショートマーの影響が打ち消されるためです(収率計算についてご参照ください)。35塩基を超えるオリゴヌクレオチドでは、逆相カートリッジ(カートリッジ)など、追加精製を推奨します。
脱塩のみの精製ではショートマーを除去できないため、保証純度を提示していません。すべてのオリゴヌクレオチドが脱塩処理されており、追加料金は不要です。
カートリッジによる精製
逆相抽出カートリッジによる精製を行えば、ワンランク上の純度が得られます(図1)。この分離法の原理は、完全長配列(疎水基である5’-DMT基を持つ)とショートマー(5’-DMT基なし)の疎水性の差を利用しています。完全長配列はカラムに残り、ショートマーは洗い流されます。カートリッジ内の5’-DMTを切断すると、求める完全長配列が溶出・回収されます。さらに、5'末端でCyanineやWellREDなど特定の色素で修飾されたオリゴヌクレオチドは、色素の構造の一部で疎水性が強まるため、カートリッジ法による精製が可能です。
オリゴヌクレオチド分子が長いほど、5’-DMT基を含むショートマー(キャップ構造のない配列から生じる産物)の割合が増える傾向があります。こうした目的外の配列は、カートリッジ法では除去できません。よって、長いオリゴヌクレオチド分子については、高速液体クロマトグラフィー(HPLC)やポリアクリルアミドゲル電気泳動(PAGE)を推奨します。カートリッジ精製では純度レベルの保証はいたしません。しかし、長年の経験により、65~80%の全長シーケンス(分析用HPLCによる)が一般的に得られることが分っています。
RP-HPLCによるオリゴ精製
逆相高速クロマトグラフィー(RP-HPLC)の原理は逆相抽出カートリッジと同じです(図1)。しかし、より分離性が良いために精製後の純度が上がります。RP-HPLCは修飾オリゴヌクレオチドの効率的な精製法です。これは、修飾したオリゴヌクレオチドには固有の疎水性があり、未修飾オリゴヌクレオチド、ショートマー、および欠損のあるショートマーから目的配列を極めて効率的に分離できるためです。さらに、RP-HPLCはカラムの容量と分離性の点で優れているため、大規模合成に最適な精製法です。ただし、疎水性に基づく分離では、オリゴヌクレオチド分子が長くなるにつれて分離性が低下します。したがって、塩基数が50を超えるオリゴヌクレオチドの精製には一般にRP-HPLCは推奨されていません。長鎖のオリゴヌクレオチド分子(最大塩基数80、場合によってはそれ以上)をRP-HPLCで精製することは可能ですが、純度および収量が低下することがあります。
通常のRP-HPLCでは、完全配列の純度が一般に85%を超えます(HPLCによる分析結果)。配列の組成によっては、さらに高い純度を得ることが可能です。RP-HPLCによる精製の料金については、営業担当またはカスタマーサービスまでお問い合わせください。
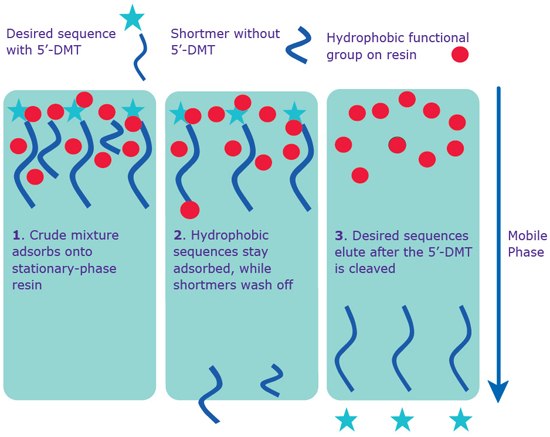
図 1.逆相抽出カートリッジおよびHPLCによる分離。通常のカートリッジ法とRP-HPLCのいずれについても、配列に5’-DMT基が結合していることで精製が進む。
IE-HPLCによるオリゴ精製
イオン交換高速クロマトグラフィー(IE-HPLC、ここでは陰イオン交換HPLC)は、オリゴヌクレオチド構造中の帯電官能基(リン酸基)の数に応じて精製します。陰イオン交換法では、第四級アンモニウム基固定相に、塩濃度勾配のある移動相を流します(図2)。少量であれば非常に高い精製能を示します。しかし、分子の長さが制約となり、通常は塩基数40以下でしか使えません。これよりも配列が長いオリゴヌクレオチドでは、完全長配列とショートマーの分離が悪くなるため、純度が低下し安定しません。
RP-HPLCではなくIE-HPLCを使用する第一の理由は、二次構造をとるオリゴヌクレオチド分子を精製するためです。二次構造は、GC含量が高い配列でよく見られます。IE-HPLCでは移動相のpHが強アルカリ性で、水素結合を切断し、ひいては二次構造を壊すことができるため、二次構造をとるオリゴヌクレオチドに効果的です。RP-HPLCの前にIE-HPLCを実施すれば、二次構造分子も精製することが可能です。詳細についてはお問い合わせください。
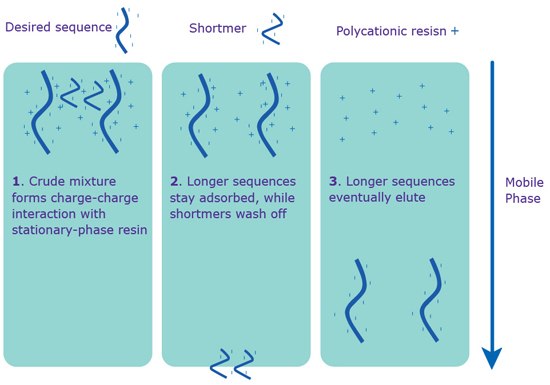
図 2.IE-HPLCによる分離。IE-HPLCによる精製は配列上に5’-DMT基がなくても進む。
PAGEによるオリゴ精製
ポリアクリルアミドゲル電気泳動(PAGE)では、変性条件を利用し、負電荷を帯びたオリゴヌクレオチドの分子量に従って分離します(図3)。適切な条件では、一塩基以外同一のオリゴヌクレオチドの分離も可能です。分子サイズによる分離能に優れたPAGEを使えば、一般に他のどの精製法よりも高い純度を得ることができます。PAGEでは、オリゴヌクレオチドの抽出に必要な手順が複雑なため、保証収量は他の精製方法よりも少なくなります。高純度が必要な場合や塩基数が50を超える配列の場合に、PAGEが推奨されます。通常、PAGEでは完全長配列の純度が95%を超えます。PAGEの料金など、詳細については営業担当またはカスタマーサービスまでお問い合わせください。
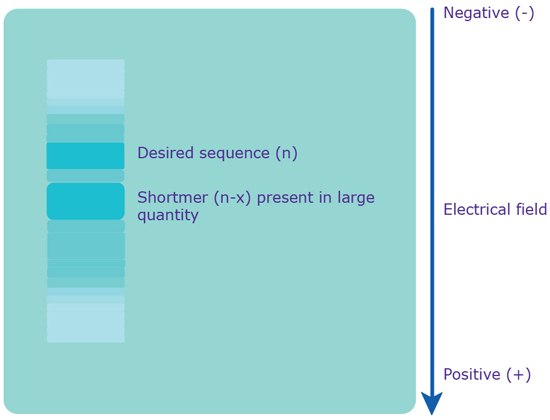
図3.PAGEによる分離。ゲルに電場をかけると多価陰イオンのオリゴヌクレオチドが正に帯電した陽極に向かって移動する。未精製サンプル全体に均一に電荷が分布しているため、配列が異なるさまざまな分子が、分子量、すなわち配列の長さに従って分離する。目的の配列は長いため、ショートマーよりもゆっくり移動する。
ゲルろ過によるオリゴ精製
ゲルろ過が推奨されるのは、in vivo実験での使用を目的とする少量オリゴヌクレオチドです(図4)。製造拠点によりますが、in vivoアンチセンスの試験でよく使われるホスホロチオエートオリゴヌクレオチド(S化オリゴ)はゲルろ過が可能です(お客様の地域でこのゲルろ過処理が利用可能かどうかは、営業担当またはカスタマーサービスまでお問い合わせください)。ゲルろ過では、精製に使用した溶媒だけでなく、合成、切断、および脱保護反応の微量な副生成物(標準的な脱塩では取り除けなかったもの)も除去できます。これらの微量副生成物は、in vitroでは通常無害ですが、in vivoでは細胞毒性を示すことがあります。
また、メルクのiScale Oligos™は、in vivoでの使用選択肢をさらに広げる、大容量製品です。
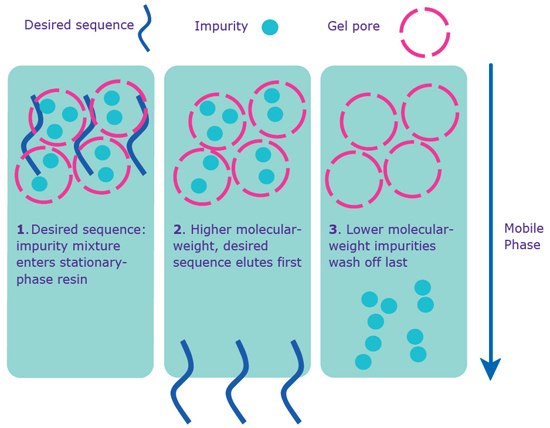
図4.ゲルろ過による分離。ゲルろ過による精製は配列に5’-DMT基がなくても進む。
次世代シーケンシング用オリゴの精製課題
上述した従来の精製法は、低分子不純物の除去に加え、完全長分子の割合を望ましいレベルに引き上げるのに効果的です。一方で、次世代シーケンシング(NGS)などの非常に高感な技法の利用が増え続けているため、クロスコンタミネーションという新たなタイプの不純物混入の問題が増えています5。従来の精製法は、クロスコンタミネーションを起こすオリゴヌクレオチドの除去には有効ではありません。オリゴヌクレオチドのハイスループット製造施設であれば、少量のクロスコンタミネーションはどこでも起こる可能性があります。通常は、PCRなどの従来技法や用途に対してこうした少量のクロスコンタミネーションが大きな影響を与えることはありません。しかし、ほとんどのNGSプラットフォームはマルチプレックスにインデックス(バーコード)アダプター配列を使用しています。シーケンシングの標的以外の分子に(クロスコンタミネーションによって)誤ったバーコードがわずかに付いてしまうと、データ解析段階まで検知できないため、問題解決に時間と費用がかかってしまいます。この問題を回避するために開発されたのが次世代シーケンシング用オリゴ(NGSO)です。NGSOは、独自の精製法を用いて製造します。NGSアダプターとしてオリゴヌクレオチドを使用したいときは、代わりにNGSOを推奨します。
オリゴヌクレオチド精製法の推奨事項
オリゴヌクレオチドは、用途に応じて1つまたは複数の方法を組み合わせると精製の結果が向上します。最初に表1で技法/用途に合った推奨の方法を調べてください。また、オリゴ精製法を最適化するには、テクニカルサービスグループ(customjp.ts@merckgroup.com)までご相談ください。メルクは、DNAやRNAのオリゴの実験デザイン、製造、修飾、精製において35年を超える経験があります。
参考文献
関連製品
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?