Stratégies de fabrication des vaccins et des produits thérapeutiques à base d'ARNm
Avec un délai réduit entre le développement et la clinique, la technologie de l'ARNm est prometteuse, non seulement en tant qu'agent rapide et efficace pour répondre aux épidémies de maladies infectieuses, mais aussi pour le développement de nouvelles thérapies destinées à traiter des maladies dont les besoins ne sont pas satisfaits. Les technologies ARNm offrent de multiples avantages : un excellent profil de sécurité, un haut degré de polyvalence et un processus de fabrication modélisé.
Avec le succès précoce des vaccins ARNm, les fabricants d'ARNm d'aujourd'hui cherchent à améliorer l'efficacité et la productivité de leurs processus de production en améliorant la stabilité de l'ARNm et en mettant en œuvre des stratégies qui améliorent la purification de l'ADNp et de l'ARNm et la mise à l'échelle jusqu'à la production BPF.
Voir tous nos produits et services pour le développement et la fabrication d'ARNm.
Aperçu de la section
Considérations pour mla fabrication d'ARN
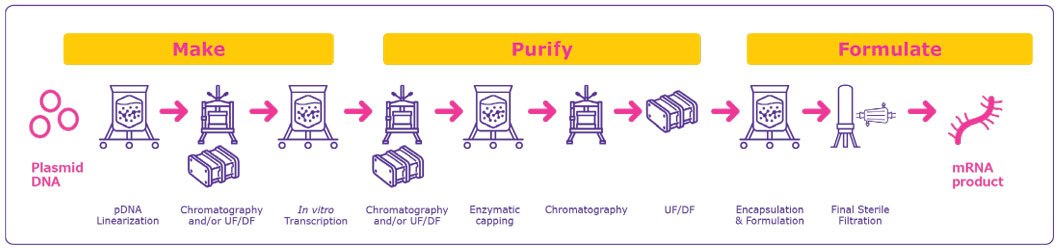
La fabrication d'ARNLa fabrication de vaccins et produits thérapeutiques à ARNm de vaccins et produits thérapeutiques à ARNm suit généralement un processus modélisé (Figure 1). Ce modèle de fabrication simplifié utilise les mêmes matériaux de réaction pour toutes les cibles et permet aux fabricants d'ARNm de produire de nouvelles molécules cibles avec un minimum d'adaptations du processus.
Cette page web vous aidera à relever ces défis et d'autres encore, en vous fournissant des informations sur nos solutions complètes et intégrées conçues pour rationaliser votre fabrication d'ARNm. Notre brochure "Process chemicals for mRNA drug manufacturing" ; fournit les détails dont vous avez besoin pour faire des choix éclairés.
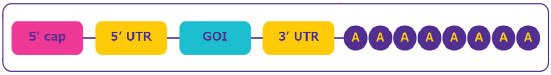
Figure 2.Structure de l'ARNm.
- Région de coiffe à l'extrémité 5' de la séquence : Essentielle pour la maturation de l'ARNm, la reconnaissance par le ribosome pour une traduction efficace des protéines, et la protection contre la digestion par les nucléases pour une meilleure stabilité.
- Régions non traduites (UTR) dans les domaines en amont et en aval de la région codante de l'ARNm : Elles régulent la traduction, la localisation et la stabilité de l'ARNm ; elles peuvent être utilisées pour améliorer l'efficacité de l'expression des protéines.
- Cadre de lecture ouvert ou région de la séquence codante : Contient le gène d'intérêt (GOI).
- La queue poly(A) : Cruciale pour la traduction des protéines et la stabilité de l'ARNm en empêchant la digestion par l'exonucléase 3'.
Making mRNA
La production de thérapies et de vaccins à base d'ARNm commence par un modèle d'ADN plasmidique (ADNp) qui est ensuite linéarisé et transcrit en ARNm.
- production d'ADNp: Le modèle d'ADNp contient un promoteur d'ARN polymérase dépendant de l'ADN et la séquence de la construction d'ARNm. L'ADNp est amplifié dans des cellules bactériennes qui sont ensuite récoltées et lysées pour libérer l'ADNp circulaire. Ce lysat est extrêmement visqueux car il contient l'ADNp et d'autres grandes impuretés chargées négativement telles que l'ARN, l'ADN génomique et les endotoxines provenant des cellules bactériennes, ce qui rend la purification difficile.
- purification de l'ADNp: La purification de la matrice d'ADNp des impuretés doit maximiser la séparation tout en minimisant le risque de dommages mécaniques à la matrice du plasmide. L'ADNp purifié et circulaire est ensuite linéarisé afin d'éviter les événements de lecture transcriptionnelle susceptibles de générer des variantes de séquences d'ARNm indésirables qui devraient être éliminées.1 Cette matrice d'ADNp linéarisée est ensuite purifiée afin d'éliminer les impuretés telles que l'enzyme de restriction utilisée pour la linéarisation, l'albumine sérique bovine (BSA), les fragments d'ADN et les endotoxines. Comme la matrice d'ADNp est généralement produite dans des cellules bactériennes, les impuretés endotoxiniques constituent une impureté critique qui a un impact sur les étapes de purification ultérieures. Des détergents tels que détergent Deviron® C16 peuvent être utilisés pour éliminer efficacement les endotoxines et constituent une alternative durable, biodégradable et conforme à la directive REACH aux détergents traditionnels.2
Il existe des différences marquées dans l'approche de la purification de l'ADNp à l'échelle du laboratoire et de la production BPF. Les processus à l'échelle du laboratoire utilisent souvent des techniques d'extraction par solvant pour séparer l'ADNp des autres composants, mais la manipulation et l'élimination de ces produits chimiques à grande échelle peuvent s'avérer difficiles. En revanche, les environnements de production GMP utilisent généralement la filtration à flux tangentiel (TFF) et la chromatographie pour éliminer efficacement les impuretés.
In-vitro transcription (IVT): L'ADNp linéarisé et purifié est ensuite transcrit en ARNm dans le cadre d'une réaction enzymatique.
- Les composants critiques pour la transcription in-vitro comprennent l'ARN polymérase, qui catalyse la transcription de l'ADN en ARNm ; les ribonucléosides triphosphates (rNTP) qui servent d'éléments constitutifs de l'ARNm ; la pyrophosphatase inorganique (IPP) qui améliore le rendement de l'ARNm ; et les inhibiteurs de RNase, qui empêchent la dégradation de l'ARN. Le tampon de transcription contient généralement dithiothreitol (DTT) pour réduire les liaisons disulfures et inhiber l'activité de la RNase, tandis que spermidine pour améliorer l'efficacité de la transcription et stabiliser les acides nucléiques. Pour minimiser le risque de dégradation enzymatique lors de cette étape critique du processus, il est essentiel de sélectionner des produits chimiques dont l'absence d'activité endonucléasique a été testée. Pour un aperçu complet de nos produits chimiques et excipients de haute qualité, y compris un large portefeuille de produits exempts d'endonucléases, consultez notre brochure "Process chemicals for mRNA drug manufacturing".
- Surveillance de la transcription: Les paramètres critiques du processus (CPP) doivent être surveillés pendant la réaction IVT afin de contrôler les attributs de qualité critiques (AQC) et d'assurer un traitement optimal. Une surveillance efficace permet une fabrication mieux contrôlée et des réponses plus rapides à la variabilité du processus.
Capuchonnage: Après la transcription, une structure de capuchon 5' est ajoutée au transcrit de l'ARNm afin d'améliorer la stabilité et la transduction dans la cellule hôte. La coiffe peut être ajoutée de deux façons :
- Coiffage co-transcriptionnel : réalisé lors de l'étape IVT. Cependant, l'efficacité et le rendement sont faibles, et cette approche peut générer des impuretés non coiffées en raison d'une mauvaise liaison ou d'une incorporation inverse.
- Le coiffage enzymatique (ou coiffage post-traductionnel) est effectué après la purification de l'ARNm. Cette approche utilise généralement une enzyme de coiffage pour ajouter la coiffe à l'ARNm purifié. Bien que cette approche soit plus efficace, elle est plus coûteuse et constitue une étape de traitement supplémentaire après la purification.
Purifier ml'ARN
Après la transcription in-vitro l'ARNm est purifié des impuretés et des matériaux utilisés dans les étapes précédentes, y compris les endotoxines, l'ARN double brin immunogène (ARNdb), l'ADN matrice résiduel, l'ARN polymérase et les impuretés élémentaires. Plusieurs options sont disponibles pour purification de l'ARNm et élimination de l'ADN résiduel.
Séparation chromatographique telle que la paire d'ions en phase inverse (IPRP), échange d'anions (AEX) et la chromatographie d'affinité (CA) utilisant la capture poly(dT) (figure 3) purifient efficacement la cible ARNm et éliminent la matrice ADN, éliminant ainsi la nécessité d'une digestion de l'ADN1, 3. La chromatographie est également utilisée après le capsulage enzymatique pour éliminer les transcrits d'ARNm indésirables et les impuretés d'oligonucléotides.

Figure 3 :Comparaison des paires d'ions en phase inversée, de l'échange d'anions et de la chromatographie d'affinité pour la purification de l'ARNm (DBC : capacité de liaison dynamique).4,5
- L'appariement ionique en phase inverse (IPRP) peut être utilisé à petite échelle pour capturer efficacement l'ARN simple brin (ARNs) cible et le séparer des impuretés. Cependant, comme cette méthode nécessite des solvants, elle est moins adaptée à la fabrication GMP et convient mieux au polissage qu'à la capture.
- Chromatographie d'échange d'anions (AEX) possède une capacité de liaison dynamique élevée et élimine efficacement les impuretés telles que l'ARNdb, l'ARN non capsulé, les hybrides ARN-ADN et d'autres structures d'ARN telles que l'ARNm en épingle à cheveux. Bien que l'AEX utilise des solutions aqueuses, elle nécessite des agents chaotropes potentiellement toxiques et des températures de fonctionnement allant jusqu'à 85 °C pour désorber les grosses molécules d'ARNm liées à la résine.
- Chromatographie d'affinité (AC) La capture du poly(dT) utilise une résine pour capturer spécifiquement la queue poly(A) des transcrits d'ARNm de pleine longueur. Cette méthode permet d'éliminer efficacement l'ADN, les nucléotides, les enzymes, les composants de la mémoire tampon et toutes les autres impuretés qui n'ont pas de queue poly(A). Pour cette raison, l'AC est couramment utilisé pour la capture initiale de l'ARNm, suivi de l'AEX pour le polissage.
- La concentration finale et la diafiltration sont effectuées après la ou les étapes de chromatographie pour maximiser la pureté du produit et transférer l'ARNm dans le tampon approprié pour la formulation ou le stockage.
Scale-up Considerations
Les technologies à usage unique offrent scalabilité, adaptabilité et qualité pour les fabricants disposant d'un large pipeline de cibles et constituent un élément clé de nombreux processus de fabrication BPF d'ARNm. La fabrication GMP exploite les avantages de la FFT ou des étapes de chromatographie pour une séparation efficace à grande échelle, remplaçant les méthodes de purification alternatives typiques du développement de processus à petite échelle. Les considérations à garder à l'esprit sont les suivantes :
- Les étapes de TFF ou de chromatographie remplacent les étapes d'extraction par solvant et de précipitation fréquemment utilisées dans le développement de processus d'ARNm.
- Des produits chimiques de haute qualité et des réactifs sans endonucléase doivent être utilisés dans la mesure du possible pour améliorer la stabilité de l'ARNm et minimiser la possibilité de dégradation de l'ARNm.
Ces dernières années ont été marquées par des succès importants dans le déploiement de vaccins à ARNm auprès de vastes populations de patients. Bien que des défis subsistent, l'accent mis sur la maximisation de la stabilité de l'ARNm en utilisant des produits chimiques de haute qualité et des réactifs sans endonucléase, en optimisant et en adaptant les technologies de purification chromatographique pour maximiser la séparation et rationaliser la mise à l'échelle, a permis de réaliser des progrès majeurs dans les modèles de fabrication BPF.
Pour que la technologie de l'ARNm atteigne son plein potentiel, des solutions innovantes, de l'expertise et de l'ingéniosité seront nécessaires pour garantir l'évolution de plateformes robustes à l'échelle de la production. Avec nos produits, nos services et notre expertise technique, nous nous engageons à développer des solutions intégrées pour rationaliser votre fabrication d'ARNm.
Références
Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?