Estrategias de fabricación de vacunas y terapias de ARNm
Con un plazo de tiempo comprimido desde el desarrollo hasta la clínica, La tecnología del ARNm es prometedora, no sólo como agente rápido y eficaz para responder a brotes de enfermedades infecciosas, sino también para el desarrollo de nuevas terapias que aborden enfermedades con necesidades no cubiertas. Las tecnologías de ARNm ofrecen múltiples ventajas: un excelente perfil de seguridad, un alto grado de versatilidad y un proceso de fabricación templado.
Con el temprano éxito de las vacunas de ARNm, los fabricantes actuales de ARNm buscan mejorar la eficiencia y la productividad de sus procesos de producción mejorando la estabilidad del ARNm e implementando estrategias que mejoren la purificación del ADNp y del ARNm y el escalado a la producción GMP.
Vea todos nuestros productos y servicios para desarrollo y fabricación de ARNm.
Resumen de la sección
- Consideraciones para la fabricación de ARNm
- Fabricación de ARNm
- Purificación-ARNm
- Consideraciones sobre el aumento de escala
Consideraciones para la fabricación de mARNm
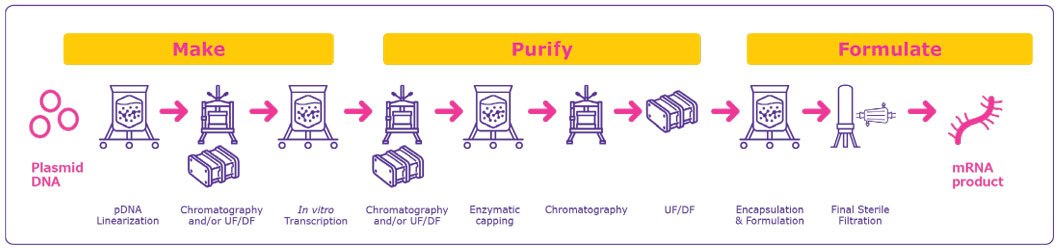
Fabricación de vacunas y terapias de ARNm de las vacunas y terapias de ARNm suele seguir un proceso con plantillas (Figura 1). Esta plantilla de fabricación simplificada utiliza los mismos materiales de reacción para cualquier diana y permite a los fabricantes de ARNm producir nuevas moléculas diana con adaptaciones mínimas de los procesos.
Vacunas y terapias de ARNm.
Varias decisiones clave tienen un impacto enorme en el proceso, el rendimiento y la calidad del producto final de ARNm, y una de ellas es la calidad de los productos químicos del proceso y de las materias primas. Especialmente durante la transcripción in vitro y la purificación posterior, el ARNm está desprotegido y expuesto a un alto riesgo de degradación enzimática. El uso de productos químicos de alta calidad sometidos a pruebas de ausencia de actividad endonucleasa minimiza el riesgo de degradación inducida por RNasas y mejora la estabilidad del ARNm durante la purificación y formulación del medicamento de ARNm.
Esta página web le ayudará a superar estos y otros retos, proporcionándole información sobre nuestras soluciones completas e integradas diseñadas para agilizar la fabricación de ARNm. Nuestro folleto "Procesos químicos para la fabricación de fármacos de ARNm" proporciona los detalles que necesita para tomar decisiones informadas.
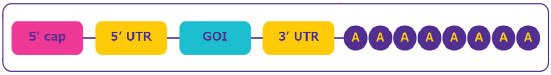
Figura 2.Estructura del ARNm.
- Región de cubierta en el extremo 5' de la secuencia: Esencial para la maduración del ARNm, el reconocimiento por parte del ribosoma para una traducción eficiente de la proteína y la protección frente a la digestión por nucleasas para mejorar la estabilidad.
- Regiones no traducidas (UTR) en los dominios aguas arriba y aguas abajo de la región codificante del ARNm: Regulan la traducción, localización y estabilidad del ARNm; pueden utilizarse para mejorar la eficiencia de la expresión de proteínas.
- Marco de lectura abierto o región de secuencia codificante: Contiene el gen de interés (GOI).
- Cola poli(A): Crucial para la traducción de la proteína y la estabilidad del ARNm al evitar la digestión por la exonucleasa 3'.
Fabricación de mARNm
La producción de terapias y vacunas basadas en ARNm comienza con una plantilla de ADN plasmídico (ADNp) que luego se linealiza y transcribe a ARNm.
- Producción de ADNp: La plantilla de ADNp contiene un promotor de ARN polimerasa dependiente de ADN y la secuencia para la construcción de ARNm. El ADNp se amplifica en células bacterianas que luego se cosechan y se lisan para liberar el ADNp circular. Este lisado es extremadamente viscoso, ya que contiene el ADNp y otras impurezas de gran tamaño y carga negativa, como el ARN, el ADN genómico y las endotoxinas de las células bacterianas, lo que dificulta la purificación.
- Purificación del ADNp: La purificación de la plantilla de ADNp de las impurezas debe maximizar la separación al tiempo que minimiza el potencial de daño mecánico a la plantilla del plásmido. A continuación, el ADNp circular purificado se linealiza para evitar los eventos de lectura transcripcional que pueden generar variantes de secuencia de ARNm no deseadas que habría que eliminar.1 Esta plantilla de ADNp linealizada se purifica aún más para eliminar impurezas como la enzima de restricción utilizada para la linealización, la albúmina de suero bovino (BSA), los fragmentos de ADN y las endotoxinas. Como la plantilla de ADNp se produce típicamente en células bacterianas, las impurezas de endotoxinas son una impureza crítica que afecta a los pasos de purificación posteriores. Detergentes como Detergente Deviron® C16 pueden utilizarse para eliminar eficazmente las endotoxinas y son una alternativa sostenible, biodegradable y conforme con REACH a los detergentes tradicionales.2
Existen marcadas diferencias en el enfoque de la purificación de ADNp a escala de laboratorio y de producción GMP. Los procesos a escala de laboratorio suelen utilizar técnicas de extracción con disolventes para separar el ADNp de otros componentes, pero la manipulación y eliminación de estos productos químicos a gran escala puede ser un reto. Por el contrario, los entornos de producción GMP suelen utilizar la filtración de flujo tangencial (TFF) y la cromatografía para la eliminación eficaz de impurezas.
Transcripción in vitro (IVT): El ADNp linealizado y purificado, se transcribe a continuación en ARNm en una reacción enzimática.
- Componentes críticos para la transcripción in vitro incluyen la ARN polimerasa, que cataliza la transcripción del ADN en ARNm; los ribonucleósidos trifosfatos (rNTP), que sirven como componentes básicos del ARNm; la pirofosfatasa inorgánica (IPP), que mejora el rendimiento del ARNm; y los inhibidores de la RNasa, que evitan la degradación del ARN. El tampón de transcripción suele contener ditiotreitol (DTT) para reducir los enlaces disulfuro e inhibir la actividad de las RNasas, mientras que se incluye espermidina para mejorar la eficacia de la transcripción y estabilizar los ácidos nucleicos. Para minimizar el riesgo de degradación enzimática en este paso crítico del proceso, es esencial seleccionar productos químicos que hayan sido sometidos a pruebas de ausencia de actividad endonucleasa. Para obtener una visión completa de nuestros productos químicos y excipientes de alta calidad, incluida una amplia cartera de productos sin endonucleasas, acceda a nuestro folleto "Procesos químicos para la fabricación de fármacos de ARNm".
- Monitorización de la transcripción: Los parámetros críticos del proceso (CPP) deben monitorizarse durante la reacción IVT para controlar los atributos críticos de calidad (CQA) y asegurar un procesamiento óptimo. Una monitorización eficaz permite una fabricación más controlada y respuestas más rápidas a la variabilidad del proceso.
Capado: Tras la transcripción, se añade una estructura cap 5' al transcrito de ARNm para mejorar la estabilidad y la transducción en la célula huésped. El capuchón puede añadirse de dos formas:
- Capuchón co-transcripcional: se realiza durante el paso IVT. Sin embargo, la eficiencia y el rendimiento son bajos, y este enfoque puede generar impurezas no capsuladas debido a una unión errónea o a una incorporación inversa.
- El capsulado enzimático (o capsulado postraduccional) se realiza después de la purificación del ARNm. Este enfoque suele utilizar una enzima de tapado para añadir el tapón al ARNm purificado. Aunque este método es más eficaz, es más caro y supone un paso de procesamiento adicional tras la purificación.
Purificación mRNA
Después de la transcripción in vitro transcripción, el ARNm se purifica de las impurezas y materiales utilizados en los pasos anteriores, incluidas las endotoxinas, el ARN de doble cadena inmunogénico (ARNdc), la plantilla de ADN residual, la ARN polimerasa y las impurezas elementales. Existen varias opciones para purificación del ARNm y eliminación del ADN residual.
Separación cromatográfica como el par iónico en fase inversa (IPRP), intercambio de aniones (AEX) y la cromatografía de afinidad (CA) mediante captura de poli(dT) (Figura 3) purifica eficazmente la diana de ARNm y elimina el ADN molde, eliminando la necesidad de digestión del ADN1, 3. La cromatografía también se utiliza después del tapado enzimático para eliminar los transcritos de ARNm no deseados y las impurezas de oligonucleótidos.
Purificación del ARNm.

Figura 3:Comparación de la cromatografía de pares de iones en fase inversa, de intercambio aniónico y de afinidad para la purificación de ARNm (DBC: capacidad de unión dinámica).4,5
- Pareamiento iónico en fase inversa (IPRP)puede utilizarse a pequeña escala para capturar eficazmente el ARN monocatenario (ARNs) diana y separarlo de las impurezas. Sin embargo, como este método requiere disolventes, es menos adecuado para la fabricación GMP y es más adecuado para el pulido que para la captura.
- Cromatografía de intercambio iónico (AEX)tiene una alta capacidad de unión dinámica y elimina eficazmente impurezas como el dsRNA, el ARN sin tapón, los híbridos ARN-ADN y otras estructuras de ARN como el ARNm en horquilla. Aunque la AEX utiliza soluciones acuosas, requiere agentes caotrópicos potencialmente tóxicos y temperaturas de funcionamiento de hasta 85 °C para desorber las grandes moléculas de ARNm unidas a la resina.
- Cromatografía de afinidad (AC)la captura de poli(dT) utiliza una resina para capturar específicamente la cola poli(A) de los transcritos de ARNm de longitud completa. Este método elimina eficazmente el ADN, los nucleótidos, las enzimas, los componentes del tampón y cualquier otra impureza que no tenga una cola poli(A). Por este motivo, el AC se utiliza habitualmente para la captura inicial de ARNm, seguido del AEX para el pulido.
- La concentración final y la diafiltración se realizan después de la(s) etapa(s) cromatográfica(s) para maximizar la pureza del producto y transferir el ARNm al tampón apropiado para su formulación o almacenamiento.
Consideraciones sobre el escalado
Las tecnologías de un solo uso ofrecen escalabilidad, adaptabilidad y calidad para los fabricantes con una gran cartera de objetivos y son un elemento clave de muchos procesos de fabricación de ARNm GMP. La fabricación GMP aprovecha las ventajas de los pasos de TFF o cromatografía para una separación eficiente a gran escala, sustituyendo métodos de purificación alternativos típicos del desarrollo de procesos a pequeña escala. Las consideraciones a tener en cuenta incluyen:
- Los pasos de TFF o cromatografía sustituyen a los pasos de extracción con disolventes y precipitación utilizados frecuentemente en el desarrollo de procesos de ARNm.
- Se deben utilizar productos químicos de alta calidad y reactivos libres de endonucleasas siempre que sea posible para mejorar la estabilidad del ARNm y minimizar la posibilidad de degradación del ARNm.
En los últimos años se han producido grandes éxitos en el despliegue de vacunas de ARNm en grandes poblaciones de pacientes. Aunque siguen existiendo desafíos, el enfoque en maximizar la estabilidad del ARNm mediante el uso de productos químicos de alta calidad y reactivos libres de endonucleasas, optimizando y adaptando las tecnologías de purificación cromatográfica para maximizar la separación y agilizar el escalado, ha dado lugar a importantes avances en las plantillas de fabricación GMP.
Para garantizar que la tecnología del ARNm alcance todo su potencial, se necesitarán soluciones innovadoras, experiencia e ingenio para garantizar la evolución de plataformas sólidas a escala de producción. Con nuestros productos, servicios y experiencia técnica, nos comprometemos a desarrollar soluciones integradas para agilizar su fabricación de ARNm.
Referencias
Para seguir leyendo, inicie sesión o cree una cuenta.
¿No tiene una cuenta?